AHDS –
Akutes hämorrhagisches Diarrhoe-Syndrom
Mag. Lisa Kulmer
Resident ECVIM-CA (Internal Medicine), Vetmeduni
Mag. Elisabeth Baszler
Univ.-Prof. Dr.med.vet. Iwan Burgener
Dipl.ECVIM-CA Dipl.ACVIM PhD,
Leiter der Klinischen Abteilung für Interne Medizin Kleintiere, Vetmeduni
Ausgabe 02/2023

Das Akute Hämorrhagische Diarrhoe-Syndrom (AHDS, früher „HGE“ für „hämorrhagische Gastroenteritis“) betrifft vor allem junge und kleinwüchsige Hunde. Eine saisonale Häufung ist in der kalten Jahreszeit zu beobachten. Bei AHDS handelt es sich stets um eine Ausschlussdiagnose, sodass andere potenzielle Ursachen für Erbrechen und blutigen Durchfall (häufig Parasiten, Parvovirose, Pankreatitis, Fremdkörper und Hypoadrenokortizismus) mittels Diagnostik abgeklärt werden müssen. Die Pathogenese ist multifaktoriell und bis dato nicht restlos geklärt. Bei rechtzeitiger Vorstellung und aggressiver Therapie ist die Prognose gut, jedoch ist bei betroffenen Hunden ein Rückfall (auch Jahre später) möglich – und AHDS prädisponiert für chronische Enteritis.
Einleitung:
AHDS war früher unter dem Synonym „hämorrhagische Gastroenteritis“ bekannt und ist eine häufig vorkommende Erkrankung beim Hund (Mortier et al., 2015). Charakteristisch ist ein plötzlicher Beginn von blutigem Durchfall („acute onset“ innerhalb von drei Tagen) und Erbrechen, welches in Hämatemesis übergehen kann. Zusätzlich präsentieren sich die Patienten meist anorektisch und lethargisch (Spielman et al., 1993; Unterer et al., 2015) sowie teilweise deutlich hämokonzentriert (Mortier et al., 2015).
Diese Erkrankung wurde bereits 1972 beschrieben – damals zwar noch mit der Aussage, dass es sich um eine sporadisch vorkommende Erkrankung handle, jedoch bereits mit der Vermutung, dass es eine Prädisposition für kleine Hunderassen und Zwergrassen gibt (Hill F.W.G., 1972; Post et al., 1978). Bis zum Jahr 2014 hatte die Erkrankung AHDS diverse Namen in der Literatur, z. B. Hämorrhagische Gastroenteritis (Post et al., 1978; Spielman et al., 1993; Unterer et al., 2011) oder akutes intestinales Blutungssyndrom (Hill F.W.G., 1972). In einer 2014 veröffentlichten Studie wurde eine fehlende Beteiligung des Magens an dieser Erkrankung gezeigt, weshalb eine Umbenennung in AHDS vorgeschlagen wurde (Unterer et al., 2014). In der Studie von Mortier et al. (2015) wurde aufgezeigt, dass Patienten, welche an AHDS leiden, sowohl signifikant jünger sind als auch ein signifikant geringeres Körpergewicht haben als die durchschnittliche Population der Hunde in derselben Klinik (Mortier et al., 2015).
Obwohl die Krankheit schon lange bekannt ist, herrscht über die auslösenden Faktoren kein Konsens. Als begünstigend werden in der Literatur vor allem alimentäre Indiskretion und Stress genannt (Shmalberg et al., 2019). Aufgrund des akuten Auftretens und der Tatsache, dass die betroffenen Hunde bis zum Krankheitsausbruch keine relevanten Vorerkrankungen zeigten, wurden sowohl bakterielle Endotoxine als auch Hypersensibilitätsreaktionen (Typ 1) als mögliche Ursachen angesprochen (Spielman et al., 1993; Unterer et al., 2011; Mortier et al., 2015).
In den vergangenen Jahren verdichteten sich die Hinweise, dass ein Vorkommen von enteropathogenen Clostridien mit dem Krankheitsausbruch in Zusammenhang stehen könnte (Minamoto et al., 2014; Unterer et al., 2014; Leipig-Rudolph et al., 2018; Sindern et al., 2018). Zur quantitativen Erfassung wurde das Vorkommen von C.-perfringens-Enterotoxin (CPE) im Kot von Hunden mit gastrointestinalen Erkrankungen und gesunden Kontrollhunden verglichen. Eine Studie ergab ein signifikant höheres Vorkommen von CPE bei Hunden mit gastrointestinalen Erkrankungen (Minamoto et al., 2014).
Eine weitere Studie aus 2014 beschreibt ebenfalls ein vermehrtes Aufkommen von CPE bei erkrankten Hunden, jedoch keinen Unterschied im Krankheitsverlauf von CPE-positiven und CPE-negativen Patienten, weshalb die Autoren einen direkten Zusammenhang zwischen dem Vorkommen von CPE und AHDS eher ausschließen (Busch et al., 2014). Eine kürzlich veröffentlichte Studie entdeckte eine Reihe neuer Toxine (netE-, netF-Toxin), isoliert aus Clostridium perfringens Typ A, und benannte diese sowohl als Ursache für die canine Gastroenteritis als auch für die nekrotisierende Enterokolitis beim Fohlen (Mehdizadeh Gohari et al., 2015). Auch eine Forschungsgruppe an der LMU München hat sich bereits mit dem neuen netE- und netF-Toxin beschäftigt und konnte zum einen ein signifikant höheres Vorkommen dieser beiden Toxine bei an AHDS erkrankten Hunden feststellen (Sindern et al., 2018), zum anderen konnte das netF-Toxin aus Proben, welche endoskopisch von Dünndarmläsionen erkrankter Tiere entnommen wurden, isoliert werden (Leipig-Rudolph et al., 2018).
Ein negativer Effekt dieser Toxine im Hundedarm konnte von uns auch in Hundedarm-Zellkulturen, sogenannten Organoiden, festgestellt werden (Manuskript eingereicht).




Diagnose:
Die Kardinalsymptome der Erkrankung sind:
• akuter hämorrhagischer Durchfall
• Hypovolämie und Dehydratation
• Vomitus (+/- blutige Beimengungen) bzw. Inappetenz
Viele Hunde zeigen einen progressiven Verlauf und die Besitzer geben einen perakuten Beginn an. Klassische Befunde bei der klinischen Untersuchung beinhalten neben Hypothermie und Salivation eine Druckdolenz im cranialen bis mittleren Abdomen (Unterer et al., 2011).
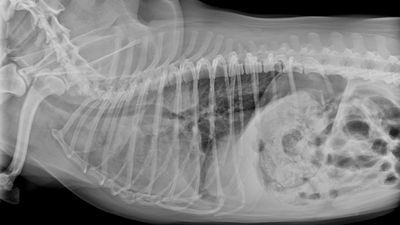
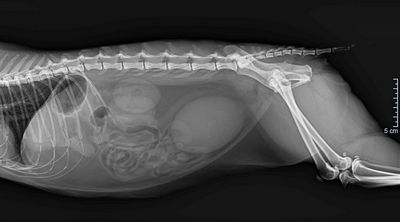
Wie bereits beschrieben handelt es sich bei AHDS stets um eine Ausschlussdiagnose, daher sollte neben einer Blutuntersuchung immer eine Kotuntersuchung (Parvovirose, Parasiten) und eine abdominale Sonografie zum Ausschluss anderer Erkrankungen – wie etwa Pankreatitis – oder eines Fremdkörpers durchgeführt werden (Unterer et al., 2015).
Therapie:
Der Grundpfeiler einer erfolgreichen Therapie ist eine aggressive intravenöse Infusionstherapie mit kristalloiden Lösungen. Initial sollte zur Stabilisierung mit wiederholten Bolusgaben begonnen werden, kolloidale Lösungen wie Voluven („HAES“) oder eine Plasmatransfusion müssen bei komplizierten Verläufen ergänzt werden. Neben gastroprotektiven, antiemetischen und analgetischen Maßnahmen profitieren die Patienten von einer fettarmen und hochverdaulichen Schonkost (Mortier et al., 2015).
Der prophylaktische Einsatz von Breitband-Antibiotika ist nicht indiziert (Unterer et al., 2015), da damit nicht nur das Mikrobiom nachhaltig zerstört wird, sondern auch Resistenzen gefördert werden, ohne dass die Antibiose einen klinischen Vorteil bringt.
Neue Therapieansätze beinhalten die Gabe von Probiotika, jedoch sollten die verwendeten Präparate speziesspezifische Mikroorganismen in ausreichender Menge enthalten (Jensen & Bjornvad, 2019; Nixon et al., 2019). Den betroffenen Patienten sollte umgehend fettarmes und hochverdauliches Futter angeboten werden, eine Nahrungskarenz gilt als obsolet.
Prognose:
Generell sind bei AHDS milde bis schwerwiegende Verlaufsformen möglich. Je schneller die Hunde eine adäquate Versorgung erhalten, desto besser ist die Prognose. Bei schweren Verläufen besteht die Gefahr, dass die Patienten durch eine bakterielle Translokation eine SIRS („Systemic Inflammatory Response Syndrome“)/Sepsis und/oder durch anhaltende hämorrhagische Verluste eine disseminierte intravasale Koagulopathie (DIC) entwickeln.
Quellen:
• K. BUSCH, J. S. SUCHODOLSKI, K. A. KUHNER, Y. MINAMOTO, J. M. STEINER, R. S. MUELLER, K. HARTMANN (2015): Clostridium perfringens enterotoxin and Clostridium difficile toxin A/B do not play a role in acute haemorrhagic diarrhea in dogs. Vet Rec 176, 253
• F. HILL (1972): Acute intestinal haemorrhage syndrome in dogs. Vet Ann 1972: 98–101
• A. P. JENSEN, C. R. BJORNVAD (2018): Clinical effect of probiotics in prevention or treatment of gastrointestinal disease in dogs: A systematic review. J Vet Intern Med 2019; 1–16
• M. LEIPIG-RUDOLPH, K. BUSCH, J. F. PRESCOTT, I. MEHDIZADEH GOHARI, C. M. LEUTENEGGER, W. HERRMANNS, G. WOLF, K. HARTMANN, J. VERSPOHL, S. UNTERER (2018): Intestinal lesions in dogs with acute hemorrhagic diarrhea syndrome associated with netF-positive Clostridium perfringens type A. Journal of Veterinary Diagnostic Investigation, 1–9
• I. MEHDIZADEH GOHARI (2015): A novel pore-forming toxin in type A clostridium perfringens is associated with both fatal canine heamorrhagic gastroenteritis and fatal necrotizing enterocolitis. PLoS One 2015; 10: e0122684
• Y. MINAMOTO, N. DHANANI, M. E. MARKEL, J. M. STEINER, J. S. SUCHODOLSKI (2014): Prevalence of Clostridium perfringens, Clostridium perfringens enterotoxin and dybiosis in fecal samples of dogs with diarrhea. Veterinary Microbiology 174, 463–473
• F. MORTIER, K. STROHMEYER, K. HARTMANN, S. UNTERER (2015): Acute haemorrhagic diarrhoea syndrome in dogs: 108 cases. Vet Rec 2015; 176: 627
• S. L. NIXON, L. ROSE, A. T. MULLER (2018): Efficacy of an orally administered anti-diarrheal probiotic paste (Pro-Kolin Advanced) in dogs with acute diarrhea: A randomized, placebo-controlled, double-blinded clinical study. J Vet Intern Med 2019; 33: 1286–1294
• N. SINDERN, J. S. SUCHODOLSKI, C. M. LEUTENEGGER, I. M. GOHARI, J. F. PRESCOTT, A. PROKSCH, R. S. MUELLER, K. BUSCH, S. UNTERER (2018): Prevalence of Clostridium perfringens netE and netF toxin genes in the feces of dogs with acute hemorrhagic diarrhea syndrome. J Vet Intern Med 2018; 1–6
• B. L. SPIELMAN, M. S. GARVEY (1993): Hemorrhagic gastro-enteritis in 15 dogs. J Am Anim Hosp Assoc 1993; 29: 314–344
• S. UNTERER, E. LECHNER, R. S. MUELLER, G. WOLF, R. K. STRAUBINGER, B. S. SCHULZ, K. HARTMANN (2015): Prospective study of bacteriaemia in acute haemorrhagic diarrhoea syndrome in dogs. Vet Rec 2015; 234
• S. UNTERER, K. STROHMAYER, B. D. KRUSE, C. SAUTER-LOUIS, and K. HARTMANN (2011): Treatment of Aseptic Dogs with Hemorrhagic Gastroenteritis with Amoxicillin/Clavulanic Acid: A Prospective Blinded Study. J Vet Intern Med; 25: 973–979
• S. UNTERER, K. BUSCH, M. LEIPIG, W. HERMANNS, G. WOLF, R. K. STRAUBINGER, R. S. MUELLER, and K. HARTMANN (2014): Endoscopically Visualized Lesions, Histologic Findings, and Bacterial Invasion in the Gastrointestinal Mucosa of Dogs with Acute Hemorrhagic Diarrhea Syndrome. J Vet Intern Med 2014; 28: 52–58
• SHMALBERG J, MONTALBANO C, MORELLI G, BUCKLEY GJ. A Randomized Double Blinded Placebo-Controlled Clinical Trial of a Probiotic or Metronidazole for Acute Canine Diarrhea. Front Vet Sci. 2019 Jun 4;6:163.