1. Die Ziele der Krebsimmuntherapie
Bereits im Jahr 1909 postulierte der Mediziner und Forscher Paul Ehrlich, dass Tumore durch das Immunsystem bekämpft und zerstört werden können, er konnte diese Annahme zu dieser Zeit aber wissenschaftlich nicht bestätigen.1 Erst die Charakterisierung der Immunzellen und die Beschreibung der T-Zellen (dendritische Zellen und NK-Zellen) machte die Forschung zur Immuntherapie gegen Krebs möglich.2–5 Die Basis der heutigen Immuntherapie gegen Krebs besteht in der Kenntnis, dass das Immunsystem transformierte Zellen im Körper aufgrund von atypischen Strukturen (Antigene) erkennen und auch zerstören kann.6 Leider kennt man auch zahlreiche Mechanismen der Tumorzellen, die das Immunsystem schwächen können. Diese Fähigkeit von Tumoren, das Immunsystem in ihrer Umgebung zu unterdrücken und dadurch das Tumorwachstum zu unterstützen, wird auch als Immuntoleranz bezeichnet.7 Das Grundprinzip und damit Ziel einer Immuntherapie gegen Krebs ist es daher, diese Immuntoleranz zu durchbrechen und die physiologische Tumorabwehr des Organismus wieder herzustellen oder sogar zu unterstützen.
2. Methoden der Krebsimmuntherapie
2.1. Therapeutische Tumorvakzination
Eine Tumorvakzine soll im Krebspatienten eine spezifische Immunreaktion gegen Tumorzellen auslösen. Diese Immunreaktion versucht man, durch Peptide, Proteine, DNA oder auch ganze Zellen auszulösen. Wir können hier zwei Arten von Tumorvakzinen unterscheiden, die tumor-assoziierte antigenbasierte Vakzine und die dentritische zellenbasierte Vakzine.
2.1.1. Tumorassoziierte antigenbasierte
Vakzine gegen Krebs
Diese Tumorvakzine enthalten entweder ein tumorspezifisches (TSA) oder tumorassoziiertes Antigen (TAA), z. B. charakteristisches Strukturprotein der Tumorzelle, zur Aktivierung der Immunantwort.
Derzeit gibt es eine einzige zugelassene therapeutische Tumorvakzine gegen das orale maligne Melanom des Hundes. Diese tumorassoziierte antigenbasierte Vakzine verwendet ein gentechnisch hergestelltes Plasmid als Antigen, welches die humane (hu) Tyrosinase (TYR) repräsentiert und eine entsprechende Antikörperbildung gegen diese speziesfremde TYR im Hundepatienten induziert. Dieses gentechnisch hergestellte Plasmid muss aufgrund des geringen Molekulargewichts mittels eines speziellen transdermalen Applikationssystems in die Haut injiziert werden.
Tyrosinase ist ein Enzym, das in physiologischen Melano-zyten zur Melaninsynthese benötigt wird und in Melanomzellen überexprimiert wird, und stellt damit ein sogenanntes tumorassoziiertes Antigen dar. Antikörper, die gegen die huTYR im Hund gebildet werden, -können aufgrund der großen Übereinstimmung (87 Prozent -Homologie zwischen huTYR und canine (can) TYR) der caninen Tyrosinase kreuzreagieren und führen damit zu einer spezifischen Immunreaktion gegen Melanomzellen und damit zu deren Zerstörung.8–12 Vergleichbar mit anderen Immuntherapien muss bei dieser Tumorvakzine der Tumor-patient vor dem Einsatz dieser spezifischen Immuntherapie mit konventionellen Methoden wie Chirurgie oder Strahlentherapie behandelt werden, da eine Immuntherapie nur mikroskopisches Residualgewebe behandeln kann. Da der physiologische Melanozyt ebenfalls Tyrosinase enthält, aber in einem geringeren Ausmaß als die Melanomzelle, kann die Behandlung als Nebenwirkung zu Pigmentierungsverlusten von Haut und Haarkleid beim Patienten führen, klinisch relevante Nebenwirkungen wurden aber bis dato nicht beschrieben.13
Eine aktuelle retrospektive Studie aus Großbritannien bestätigt die Ergebnisse der bisher publizierten Daten und beschreibt zudem palliative Wirkung bei makroskopischen Melanompatienten.14 Erst kürzlich wurde diese Vakzine auch bei Katzen mit malignen Melanomen auf deren unbedenkliche Anwendung und damit Sicherheit überprüft, und die Ergebnisse bestätigten deren sichere Anwendbarkeit auch bei dieser Spezies.15
2.1.2. Dendritische Zellenbasierte Vakzine gegen Krebs
Die dendritische zellenbasierte Vakzine, auch Krebsimpfung mit dendritischen Zellen genannt, soll eine Antigenpräsentation durch dendritische Zellen im Patienten auslösen.
Als Beispiel soll eine Vakzine herangezogen werden, die von Dr. Grammel 2003 als immunologische Therapie mit dendritischen Zellen zur Behandlung von Tumoren bei Hunden, Katzen und Pferden entwickelt wurde.
Dendritische Zellen entwickeln sich entweder aus Monozyten oder Vorläuferzellen der B- oder T-Lymphozyten und sind Bestandteil des Immunsystems. Bei der Entstehung von Tumoren und damit entartetem Fremdgewebe im Organismus sind dendritische Zellen dafür verantwortlich, diese Tumorzellen zu identifizieren (Antigen-Erkennung) und für die Eradikation durch T-Lymphozyten vorzubereiten (Antigen-Präsentation). Das Präparat verwendet dafür Blut der Tumorpatienten, um aus Mono-zyten durch Zugabe von Zytokinen dendritische Zellen zu kultivieren. Diese werden danach dem Patienten injiziert, um die körpereigene Immunabwehr zu stärken und damit die Immuntoleranz zu durchbrechen.
2.2. Immunmodulierende Therapien gegen Krebs
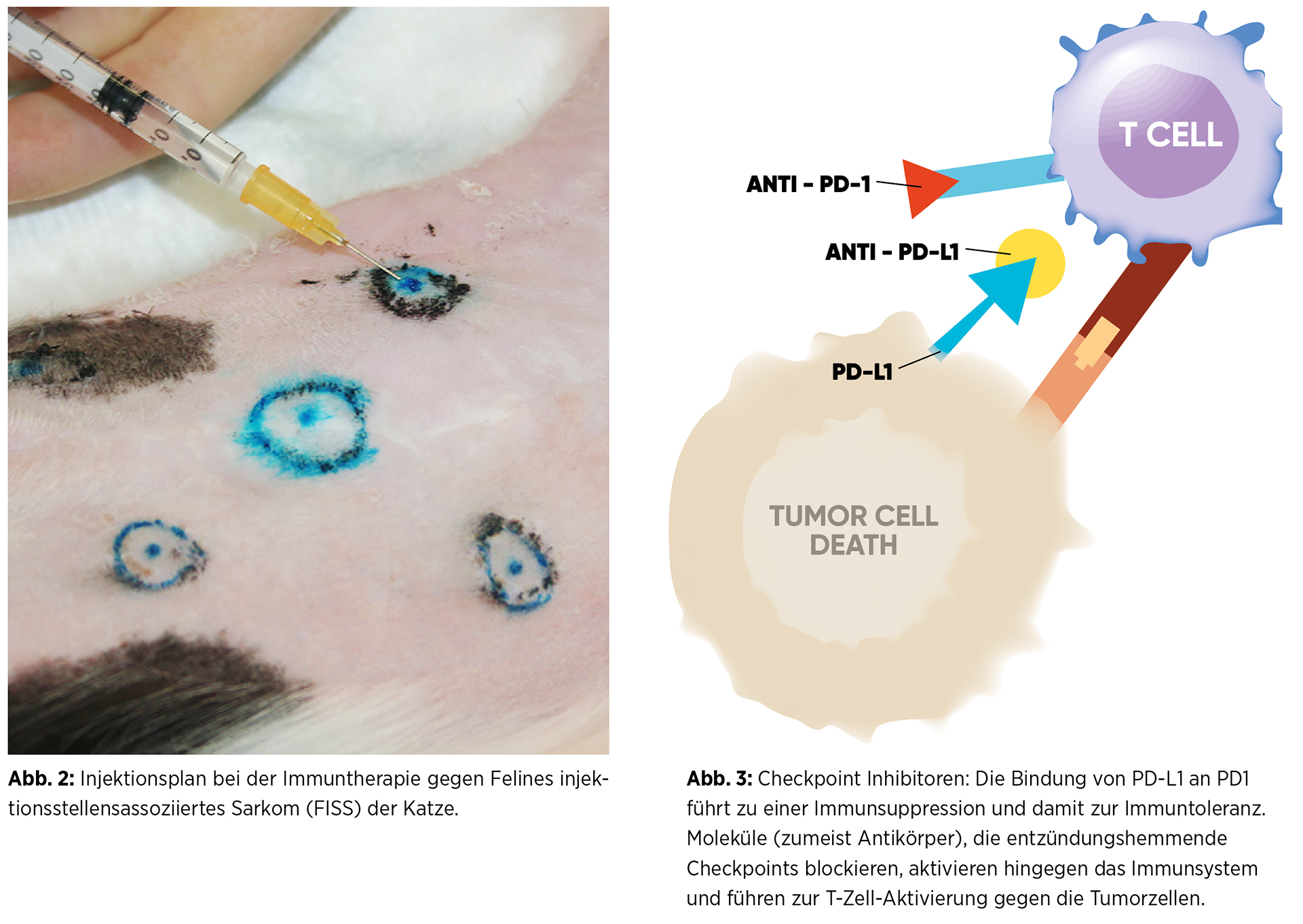
Als Beispiel kann ein Produkt zur Behandlung von Felinem injektionsstellenassoziiertem Sarkom (FISS) der Katze, auch Fibrosarkom genannt, dienen. Dieses Medikament enthält eine feline Interleukin-2-Rekombinante des Kanarienpockenvirus und wurde in Kombination mit der Strahlentherapie zur Behandlung von resezierten FISS bei Katzen ohne Metastasierung zugelassen. Diese Immuntherapie soll die Rezidivrate senken oder deren Auftreten verzögern.16 Es wurde für die Herstellung dieser Vakzine ein attenuiertes transfiziertes Pockenvirus verwendet, um das feline Interleukin-2-Gen (IL-2) zu exprimieren. Das immunstimulierende Zytokin IL-2 soll damit lokal die Immunabwehr gegen Tumorzellen induzieren. Dazu wird das attenuierte Pockenvirus im Bereich der Tumorresektion entsprechend der Herstellerangaben viermal im Abstand von einer Woche an fünf Lokalisationen injiziert (Abb. 2). Es kommt in der Folge für einige Tage zu einer lokalen Produktion von IL-2 und damit zu einer lokalisierten Immunstimulation und infolgedessen zu einer regionalen Tumorabwehr.
In der klinischen Zulassungsstudie wurden Katzen mit einem metastasenfreien FISS in zwei Gruppen eingeteilt. Die Kontrollgruppe wurde operiert und erhielt eine Strahlentherapie, die Behandlungsgruppe wurde mit dem genannten Produkt zusätzlich zur Operation und Strahlentherapie behandelt. Zwei Jahre nach der Behandlung zeigte sich bei den mit dem erwähnten Produkt behandelten Katzen eine längere rezidivfreie Periode (über 730 Tage) im Vergleich zur Kontrollgruppe (287 Tage).17
2.3. Tumorspezifische monoklonale Antikörper gegen Krebs
Monoklonale Antikörper (mAbs) sind in Zellkulturen oder Bakterienkulturen hergestellte Antikörper, die sich entweder direkt gegen tumorspezifische Antigene (TSA) oder tumorassoziierte Antigene (TAA) richten. Diese monoklonalen Antikörper werden unkonjugiert und konjugiert (z. B. an zytotoxische Substanzen, Radionuklide etc.) äußerst erfolgreich in der Humanonkologie eingesetzt. Unkonjugierte Antikörper binden an den tumorassoziierten oder tumorspezifischen Antigenen und aktivieren das Immunsystem entweder über das Komplementsystem oder spezifische Immunzellen und führen zur Zellzerstörung (Zytotoxizität).18 Monoklonale Abs können z. B. zytotoxische Substanzen, Radionuklide oder Zytokine direkt an die Tumorzelle bringen, um nach der Bindung unmittelbar wirksam zu werden (konjugierte mAbs). -Lange Zeit wurden mAbs aufgrund der Notwendigkeit einer speziesspezifischen Herstellung und der sehr hohen Kosten nicht für die Veterinäronkologie hergestellt. Aufgrund des technischen Fortschritts der letzten Jahre wird auch die Produktion für hundespezifische, sogenannte -caninisierte Antikörper für die Industrie wirtschaftlich möglich.
Zahlreiche klinische Studien untersuchen seither das Potenzial hundespezifischer Antikörper, und es wurden bereits erste Antikörper gegen B-Zell-spezifische Oberflächen-Epitop CD20 für die Behandlung von B-Zell- Lymphomen des Hundes von der FDA (Food and Drug Administration – staatliche Lebensmittelüberwachungs- und Arzneimittelzulassungsbehörde der USA) zugelassen. Leider erweist sich dieser Antikörper in Folgestudien als nicht so wirksam wie erwartet.19 Weitere Antikörper gegen CD20 sind bereits in klinischen Studien und erweisen sich als vielversprechender (unpublizierte Daten).