Das Mikrobiom im Tier –
eine unbekannte Welt
Dr. med. vet. Nina Machac
Ausgabe 04/2020

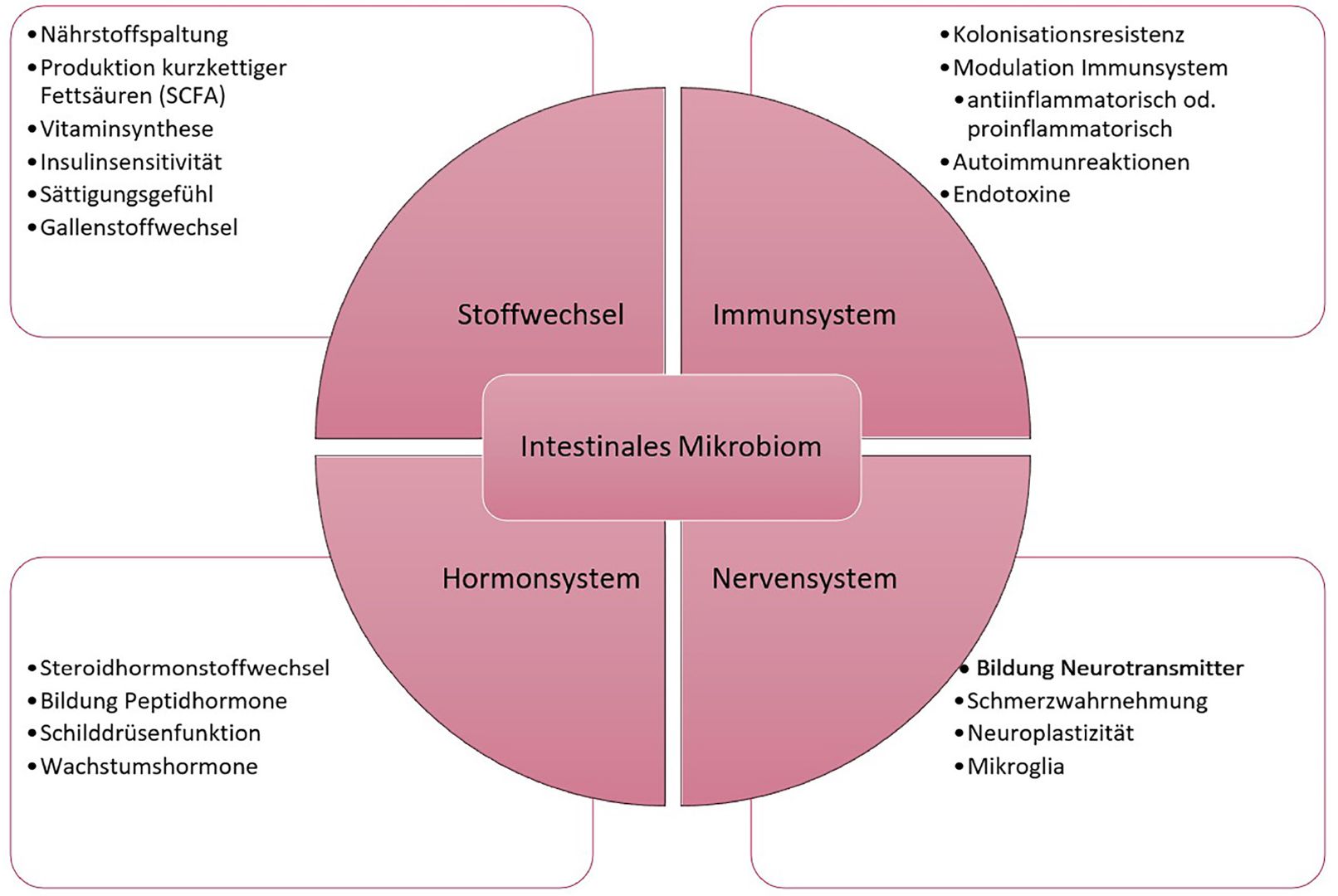
Das Mikrobiom ist für die Veterinärmedizin mehr als beachtenswert – es hat vermutlich Auswirkungen auf Immunsystem, Leberfunktion, Gehirn, Verdauung, Appetit, Entzündung und Hormonhaushalt.
Seit die Idee geäußert wurde, der Stoffwechselleistung aller den menschlichen Körper besiedelnden Mikroorganismen Aufmerksamkeit zu schenken, da diese etwa 100 Mal mehr Gene aufweisen als ebendieser menschliche Körper, steht das Mikrobiom im Fokus der Wissenschaft.
Zum Mikrobiom zählen Viren, Bakterien, Archaeen und Pilze. Der Großteil der Bakterien sind Kommensale, manche sind sogar Symbionten, die wenigsten sind Pathogene. Die Funktionen dieser Bakterien sind äußerst vielfältig: Sie spalten Nahrungsbestandteile, produzieren Vitamine, kurzkettige Fettsäuren, Aminosäuren, Neurotransmitter, Bakteriocine, Antimykotika, antivirale Substanzen, Alkohol und Endotoxine. Bakterien dekonjugieren und dehydroxylieren Gallensäuren, Steroidhormone und Medikamente und können deren Verstoffwechslung und Wirkung beeinflussen.
In beinahe jedem Organ wurde mittlerweile bakterielle DNA nachgewiesen, die Wirkung der Bakterien auf Immunsystem, Leberfunktion, Gehirn, Verdauung, Appetit, Entzündung, Hormonhaushalt, Knochenauf- und -abbau, Muskelregeneration und -aufbau, Insulinresistenz, Nierenfunktion und Herz ist momentan Gegenstandintensiver Forschung.
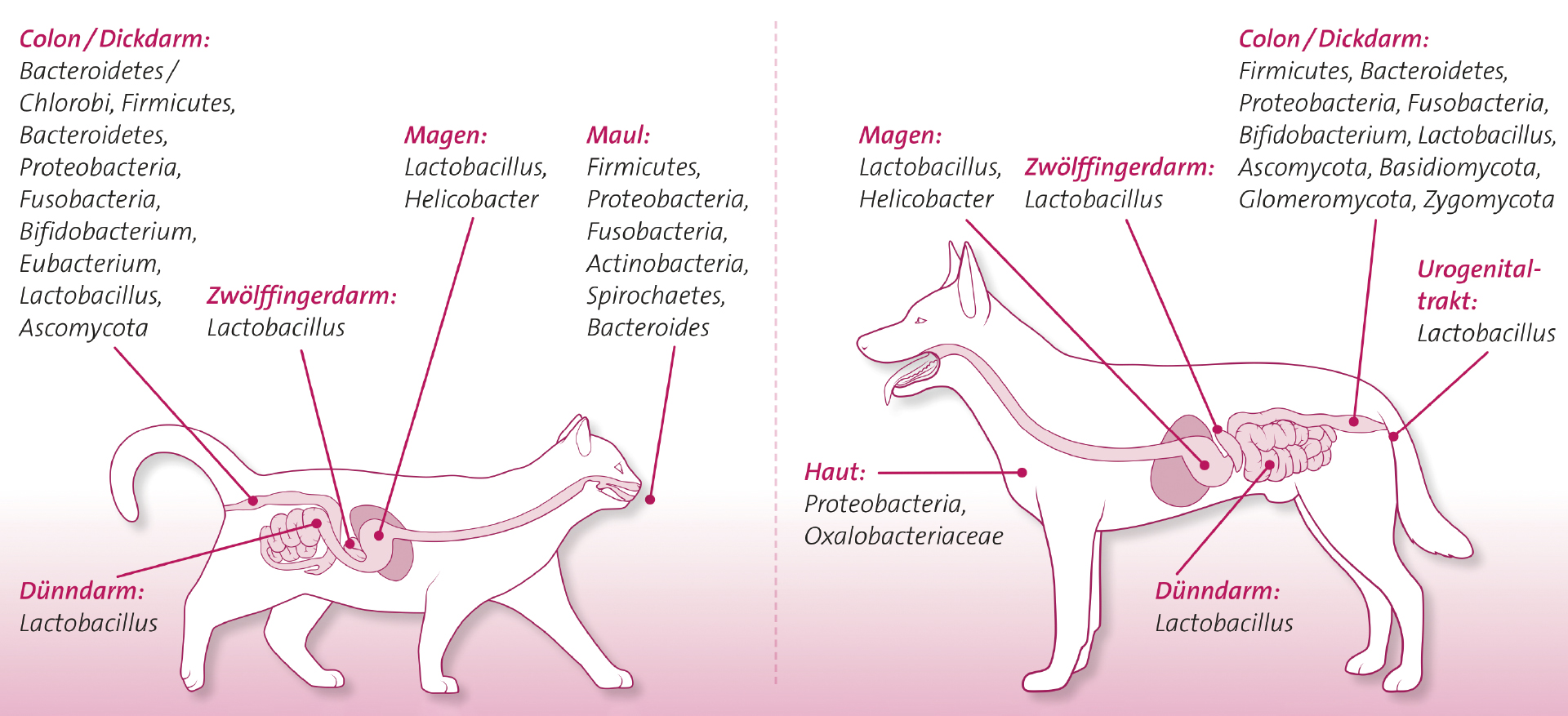
Am besten erforscht ist das Darmmikrobiom, das sich je nach Abschnitt des Verdauungstraktes unterschiedlich zusammensetzt. Das intestinale Mikrobiom von Säugetieren wird von fünf Phyla (Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria, Fusobacteria) dominiert. Katze, Hund und Mensch zeigen sogar eine ähnliche Verteilung der Bakterienklassen1 (Abb. 2).
Eine Störung des Mikrobioms nennt man Dysbiose. Die Diversität und einzelne Bakteriengruppen sind dabei reduziert; andere, beispielsweise Pathogene, konnten sich unverhältnismäßig stark vermehren. Eine Dysbiose führt zu einer gestörten Stoffwechselleistung des Mikrobioms (Metabolom) und damit zu Entzündung, verminderter Nährstoffspaltung und reduzierter Vitaminproduktion.
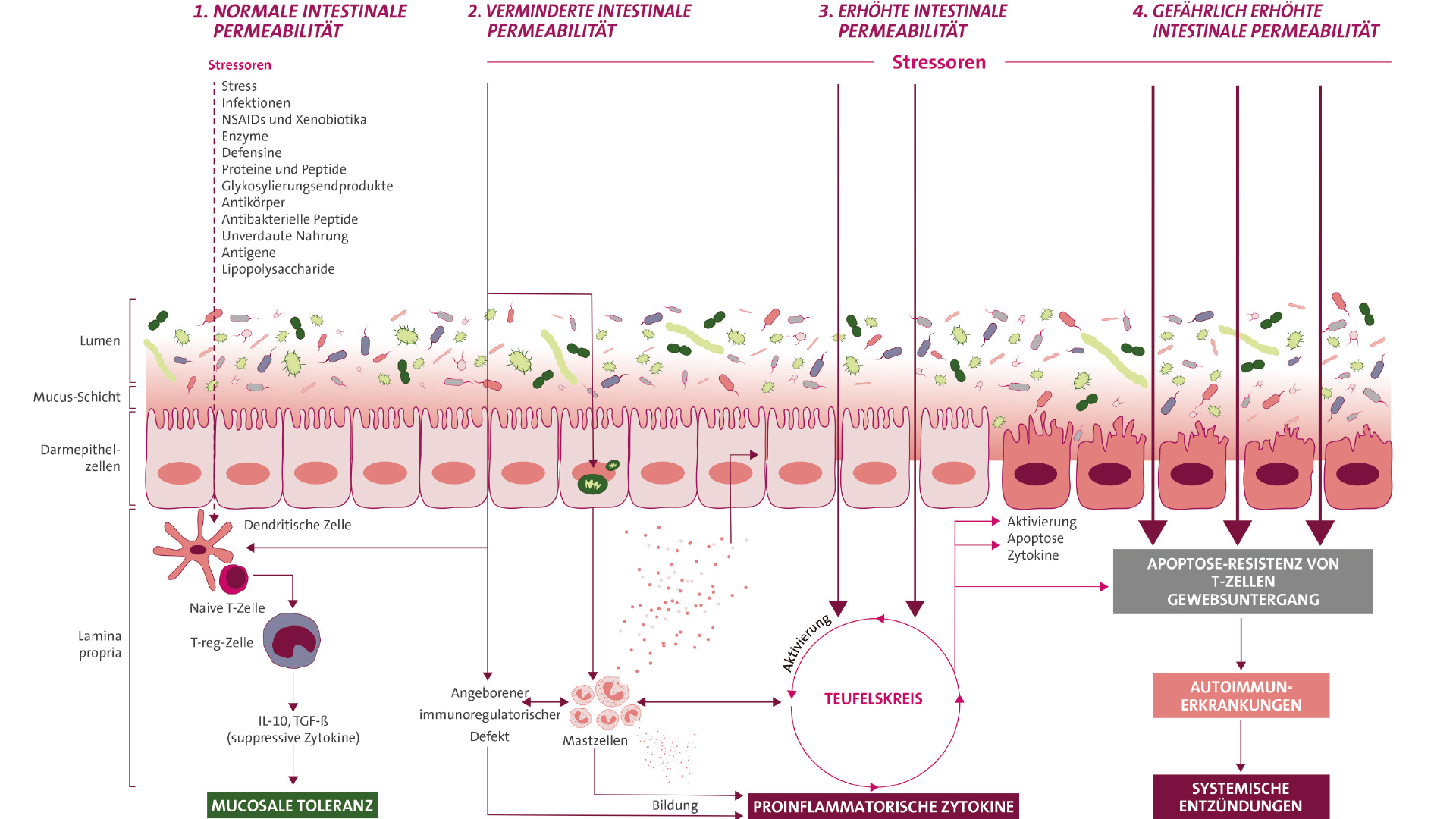
Circa 50 bis 80 Prozent (je nach Tierart unterschiedlich) des lymphatischen Apparats befinden sich im Darm, man bezeichnet dieses Gewebe als Mucosa Assocciated Lymphoid Tissue (MALT)2. Das MALT ist neben dem Mikrobiom, dem Mucus und den Darmepithelzellen Teil der drei-schichtigen Darmbarriere.
Die dem Darm aufliegende Schleimschicht schützt den Körper nicht nur vor schädlichen Umwelteinflüssen und pathogenen Keimen, sondern auch vor einem zu intensiven Kontakt des Immunsystems mit der Darmmikrobiota. Während in der äußeren Mucusschicht viele, auch kommensale Bakterien zu finden sind, ist eine dünne innere Schleimschicht nahezu steril2.
Bestimmte Oberflächenmoleküle der Bakterien (Microbial Associated Molecular Patterns – MAMPs) können unterschiedliche Immunzellen aktvieren und eine massive Ausschüttung proinflammatorischer Zytokine auslösen. So kann eine Überwucherung mit pathogenen Bakterien oder auch eine Einwanderung von Bakterien in die innerste Schleimschicht zu einem generellen proinflammatorischen Status des Immunsystems führen2. Dendritische Zellen dagegen sind antigenpräsentierende Zellen, können Bakterien oder Bakterienbestandteile aufnehmen und diese T-Zellen präsentieren, die wiederum entweder eine Immuntoleranz oder eine Immunreaktion vermitteln2.
Während TH1-Zellen und TH2-Zellen für eine zelluläre und humorale Immunantwort verantwortlich sind, kann man regulatorische T-Zellen (Tregs) als ihre Gegenspieler betrachten, da sie antiinflammatorisches IL-10 und IFN-β ausschütten. Im gesunden Darm bilden sie die Mehrheit der T-Zellen12.
Eine Dysbiose führt nicht nur zur Schädigung des Darmepithels durch pathogene Keime, sondern kann durch die direkte Aktivierung des Immunsystems zu Entzündungsreaktionen führen, die Darmbarriere schädigen und so zu einer erhöhten Permeabilität der Darmwand führen – ein sogenanntes „Leaky Gut“ ist entstanden (Abb. 3).
Bei einer Vielzahl von Erkrankungen lassen sich negative Veränderungen im Darmmikrobiom finden. Das beschränkt sich nicht nur auf Darmerkrankungen, sondern auch Übergewicht, Diabetes mellitus Typ 1 und Typ 2, Depression, Morbus Parkinson, rheumatische Arthritis, Neurodermitis, Leberzirrhose, Sepsis und chronische Niereninsuffizienz sind mit einer dysbiotischen Darmflora assoziiert.
Bei Hund und Katze konzentriert sich die Forschung aktuell auf den Verdauungstrakt, jedoch konnten einige Studien Veränderungen des Darmmikrobioms auch bei chronischer Niereninsuffizienz, Atopie, Magendrehung, Übergewicht, exokriner Pankreasinsuffizienz, FCoV-Infektion und FIV-Infektion zeigen. Ob diese Mikrobiomveränderungen Ursache oder Folge der Erkrankung sind, ist noch nicht abschließend geklärt12.
Viele Einflüsse wirken auf das Mikrobiom ein, allen voran die Ernährung. Eine Vielzahl an Studien konnte bei Hund und Katze den Einfluss verschiedener Rationen zeigen, die sich in Proteingehalt, Kohlenhydratanteil und Faseranteil unterschieden12.
Der Einsatz von Antibiotika beeinflusst das Mikrobiom intensiv, bei Hund und Katze konnten mehrere Studien den negativen Einfluss von Tylosin, Amoxicillin/Clavulansäure oder Clindamycin nachweisen3, 9, 13, 14; aber auch Medikamentengebrauch abseits von Antibiotika muss berücksichtigt werden. Eine 2018 in „Nature“ veröffentlichte Studie zeigte eine direkte antimikrobielle Wirkung von circa einem Viertel aller getesteten Medikamente8.
Besonders bei akutem Durchfall konnten Probiotika zu einer verbesserten Kotkonsistenz und einer kürzeren Dauer des Durchfalls führen7. Auch ein synergistischer Effekt von Metronidazol und E. faecium SF68 (in der EU zugelassen als Enterococcus faecium NCIMB 10415 bzw. Enterococcus faecium DSM 10663/NCIMB 10415) zur Therapie einer Giardien-Infektion wurde beschrieben4; eine alleinige Gabe von E. faecium reichte allerdings nicht aus, Giardien erfolgreich zu bekämpfen11.
Dünner wird die Studienlage bei chronischen Durchfällen, auch wenn eine Studie einen vergleichbaren Effekt von Prednisolon und einem Multistrain-Probiotikum auf klinische und histologische Parameter fand und zudem durch die Langzeitgabe des Probiotikums die Dysbiose beseitigt werden konnte10. Eine geringe Zahl an Forschungsarbeiten gibt es zu atopischer Dermatitis, chronischer Niereninsuffizienz, FHV-Infektion und Megakolon. Aufgrund der oft schlechten Qualität der Studien und Heterogenität hinsichtlich Dosierung und Wahl des Probiotikums lassen sich jedoch keine endgültigen Schlüsse ziehen7.
Ein Blick in die Humanmedizin gibt Anstöße für weitere Forschungsthemen zum Einsatz von Probiotika in der Veterinärmedizin bei Adipositas, Halitosis, Diabetes mellitus, NAFLD, atopischem Ekzem, Reizdarm sowie chronischen entzündlichen Darmerkrankungen.
Das Mikrobiom und dessen Beeinflussung durch Ernährung, Lebensstil und Medikamente stellt einen neuen Faktor dar, den es auch in der Veterinärmedizin zu beachten gilt und der neue Therapieansätze aufzeigt.
Quellen
1. Deng P., Swanson K. S. 2015. Gut microbiota of humans, dogs and cats: current knowledge and future opportunities and challenges. Br. J. Nutr. 113: S. 6–17.
2. Eissa N., Kittana H., Gomes-Neto J. C., Husein H. 2019. Mucosal immunity and gut microbiota in dogs with chronic enteropathy.
Res Vet Sci, 122: 156–164
3. Espinosa-Gongora C., Jessen L. R., Kieler I. N., Damborg P., Bjørnvad C. R., Gudeta D. D., Santos, T. P., Sablier-Gallis F., Sayah-Jeanne S., Corbel T., Nevière A., Hugon P., Saint-Lu N., Gunzburg J., Guardabassi L. 2020. Impact of Oral Amoxicillin and Amoxicillin/Clavulanic Acid Treatment on Bacterial Diversity and β-Lactam Resistance in the Canine Faecal Microbiota. J Antimicrob Chemother, 75 (2): 351–361
4. Fenimore A., Martin L. and Lappin M. R. 2017. Evaluation of Metronidazole With and Without Enterococcus Faecium SF68 in
Shelter Dogs With Diarrhea. Top Companion Anim Med, 32 (3): 100–103.
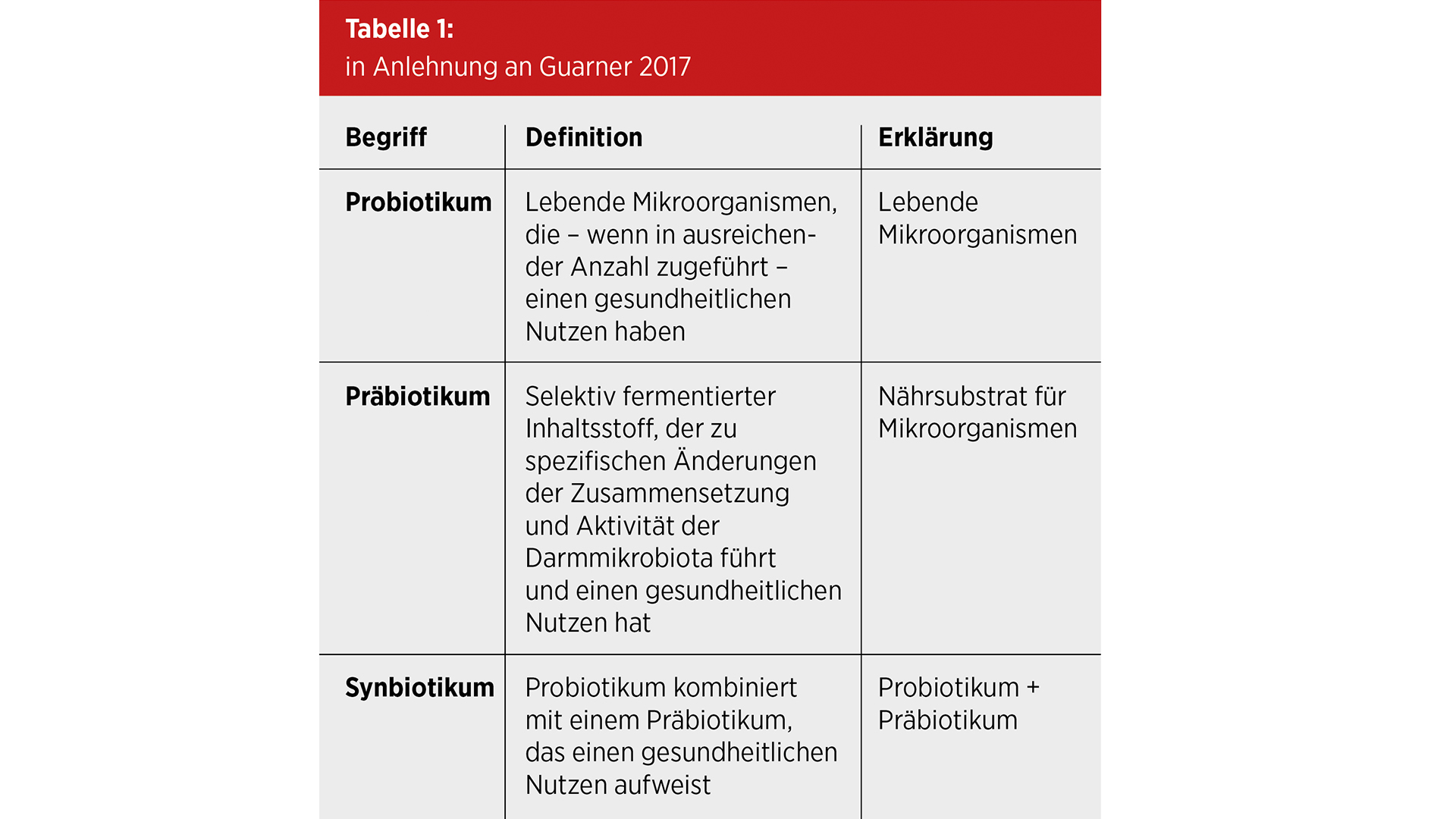
5. Guarner, F., Sanders M., Eliakim R., Fedorak R., Gangl A., Garisch J. 2017. Probiotics and Prebiotics. World Gastroenterology Organization Global Guidelines.
6. Grześkowiak Ł., Endo A., Beasley S. and Salminen S. 2015. Microbiota and probiotics in canine and feline welfare. Anaerobe, 34: 14–23.
7. Jugan M. C., Rudinsky A. J., Parker V. J., Gilor C. 2017. Use of probiotics in small animal veterinary medicine. J Am Vet Med Assoc, 250: 519–528.
8. Maier L., Pruteanu M., Kuhn M., Zeller G., Telzerow A., Anderson E. E., Brochado A. R., Fernandez K. C., Dose H., Mori H., Patil K. R., Bork P., Typas A. 2018. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature, 555: 623–628.
9. Manchester A. C., Webb C. B., Blake A. B., Sarwar F., Lidbury J. A., Steiner J. M., Suchodolski J. S. 2019. Long-term impact of tylosin on fecal microbiota and fecal bile acids of healthy dogs. J Vet Intern Med, 33: 2605–2617.
10. Rossi G., Pengo G., Caldin M., Palumbo-Piccionello A., Steiner J. M., Cohen N. D., Jergens A. E., Suchodolski J. S. 2014. Comparison of Microbiological, Histological, and Immunomodulatory Parameters in Response to Treatment with Either Combination Therapy with Prednisone and Metronidazole or Probiotic VSL#3 Strains in Dogs with Idiopathic Inflammatory Bowel Disease. PLoS One, 9(4): e94699.
11. Simpson K. W., Rishniw M., Bellosa M., Liotta J., Lucio A., Baumgart M., Czarnecki-Maulden G., Benyacoub J. and Bowman D. 2009. Influence of Enterococcus faecium SF68 Probiotic on Giardiasis in Dogs. J Vet Intern Med, 23: 476–481.
12. Pilla R. und Suchodolski J. S. 2020. The Role of the Canine Gut Microbiome and Metabolome in Health and Gastrointestinal Disease. Front Vet Sci, 6: 498.
13. Torres-Henderson C., Summers S., Suchodolski J. S., Lappin M. R. 2017. Effects of Enterococcus Faecium Strain SF68 on Gastrointestinal Signs and Fecal Microbiome in Cats Administered Amoxicillin-Clavulanate.
Top Companion Anim Med, 32 (3):104–108.
14. Whittermore J. C., Stokes J. E., Price J. M. and Suchodolski J. S. 2019. Effects of a synbiotic on the fecal microbiome and metabolomic profiles of healthy research cats administered clindamycin: a randomized, controlled trial. Gut Microbes, 10(4): 521–539.
