Leishmaniose
beim Hund
Priv.-Doz. Dr. Michael Leschnik
Ausgabe 11/2019

Einst in Süd- und Osteuropa verbreitet, scheinen sich Sandmücken als Überträger von Leishmaniose zunehmend auch in Österreich zu verbreiten. Die Infektionsprophylaxe nimmt eine zentrale Stellung in der Epidemiologie ein.
Erreger und Verbreitungsgebiete
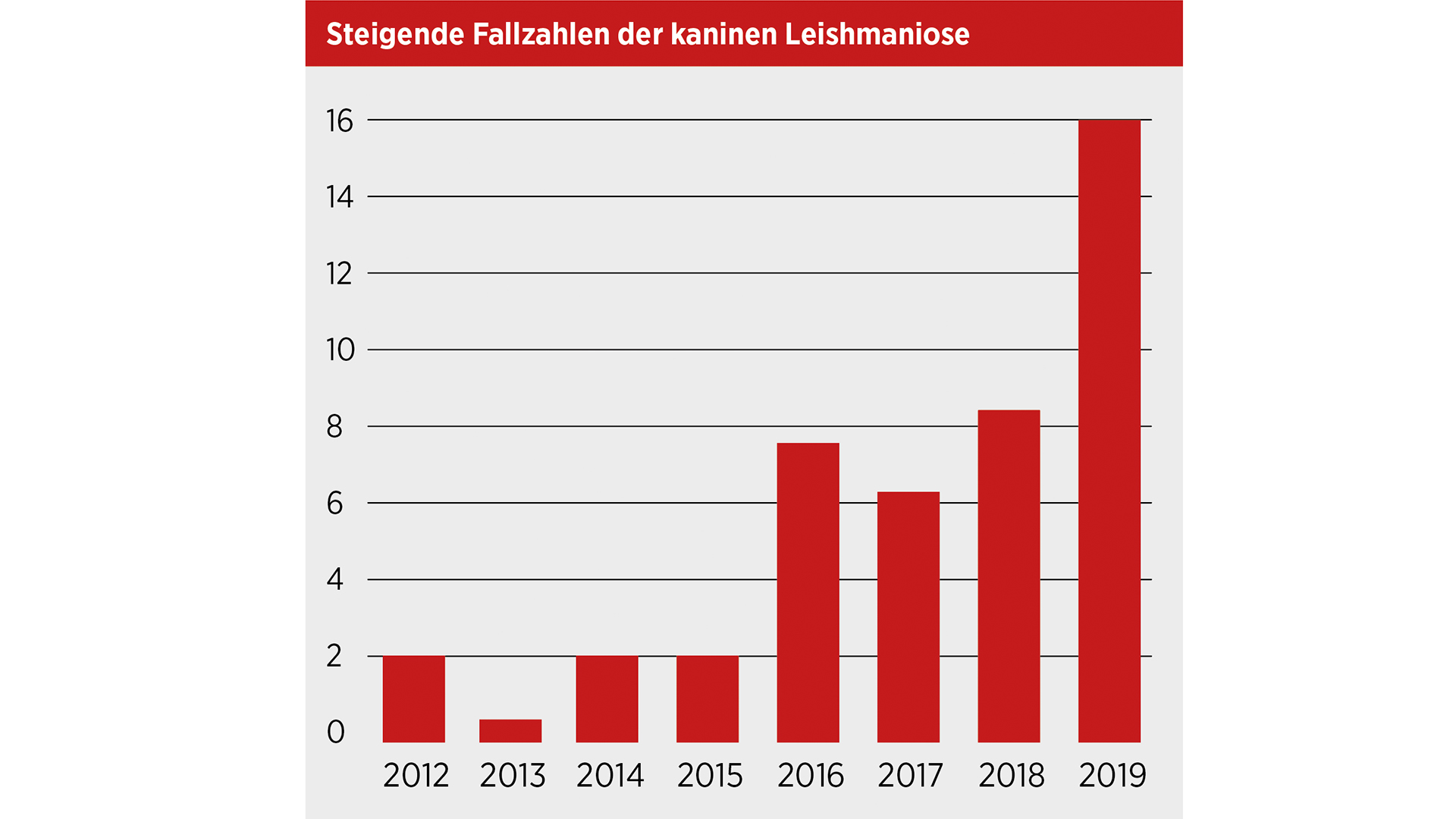
Leishmania infantum ist ein protozoärer Gewebeparasit und verursacht beim Hund eine lebensbedrohende Infektionserkrankung. Der Erreger wird v. a. in Süd- und Osteuropa durch den Blutsaugakt von Sandmücken (Phlebotominae) übertragen. Sandmücken wurden in den letzten Jahren vermehrt auch in Mitteleuropa gefunden, wobei deren Vektorkompetenz nicht in jedem Fall geklärt ist. In Anbetracht der sich stetig ändernden klimatischen Bedingungen scheint eine Vermehrung der Sandmücken in einigen Regionen Österreichs möglich, was das Auftreten autochthoner Fälle der kaninen Leishmaniose wahrscheinlicher werden lässt. In Österreich wurden nach Jahren stabiler Fallzahlen zuletzt wieder deutlich steigende Zahlen nachgewiesen (Abb. 1). Die Ursachen dafür scheinen vielfältig:
1) Weiterhin hohe Reisetätigkeit mit Hunden in die klassischen Urlaubsländer am Mittelmeer (wie Italien, Spanien und Griechenland) ohne ausreichende Prophy-laxemaßnahmen.
2) Steigende Importzahlen von adulten Hunden aus Ost- und Südosteuropa. Dort haben sich in den letzten Jahren zahlreiche neue endemische Gebiete etabliert, wie in Rumänien, Bulgarien, Serbien und Südungarn.
3) Ein zunehmendes Bewusstsein der österreichischen Tierärzteschaft gegenüber dieser Importzoonose beim Hund und damit ein vermehrtes Testen der reisebegleitenden Hunde sowie der Importhunde.
Pathomechanismus
Leishmanien können durch Sandmücken, aber auch durch den Deckakt, vertikal vom Muttertier auf die Welpen und durch Bluttransfusionen übertragen werden. Nur in der Sandmücke vermehren sich Leishmanien als begeißelte promastigote Form. Nach der Übertragung in die Haut wird der Erreger von neutrophilen Granulozyten und T-Lymphozyten (CD4+-T-Helferzellen) attackiert. In dieser Situation kann der Wirt die Leishmanien noch eliminieren. Ist diese Immunbarriere allerdings durchbrochen, besiedelt der Erreger in erster Linie Makrophagen im retikuloendothelialen System. Dort ist er bei der nun ansteigenden Antikörperproduktion nicht mehr angreifbar, es kommt zur chronisch persistierenden Infektion. Genetische Faktoren des Hundes spielen eine Rolle in der Erkrankungsprävalenz. Somit kann durch genetische Selektion des Wirtes die teilweise niedrige Erkrankungsrate in endemischen Gebieten erklärt werden. Eine Geschlechtsprädisposition besteht nicht. Nach der Erstinfektion des Wirtes können niedrige Antikörpertiter entstehen, die nach der Erregerelimination in der Haut wieder absinken, bei Überwinden der Eintrittspforte aber rasch und nachhaltig zu hohen Titern ansteigen. Derzeit wird geschätzt, dass eine spontane Erregerelimination durch den Hund bei jedem achten Infektionsfall eintritt. Nach der systemischen Streuung kann das Immunsystem des Wirtes der weiteren Erregervermehrung nur mehr eingeschränkt entgegen-treten. Faktoren wie z. B. Co-Infektionen und immunsupprimierende Medikamente spielen hier eine große Rolle.
Klinische Symptome
Die Organmanifestationen, Symptome und Laborbefunde der kaninen Leishmaniose sind oft unspezifisch und sehr variabel. Das Einsetzen der Symptome wird erst viele Monate oder auch Jahre nach der eigentlichen Infektion beobachtet. Neben Hauteffloreszenzen werden Lymphadenomegalie, Splenomegalie, entzündliche Augenerkrankungen sowie Lahmheit, Muskelatrophie und Gewichtsverlust diagnostiziert (Abb. 2). Nicht regenerative Anämien resultieren aus einer verminderten Erythropoese durch fortgeschrittene Nierenerkrankungen und dem möglichen Auftreten einer immunvermittelnden Hämolyse. Zusätzlich führt die Produktion von spezifischen Immunglobulinen zur Hypergammaglobulinämie und damit später zum Hyperviskositätssyndrom, welches wiederum die Blutungsneigung fördert. Zu Beginn der Infektion deutet oft nur eine milde Proteinurie auf das Vorhandensein einer Nephropathie hin, später kommt es zur Azotämie mit Polydipsie, Polyurie und im Endstadium zum nephrotischen Syndrom mit renalem Albuminverlust und Thromboseneigung.
Diagnostik
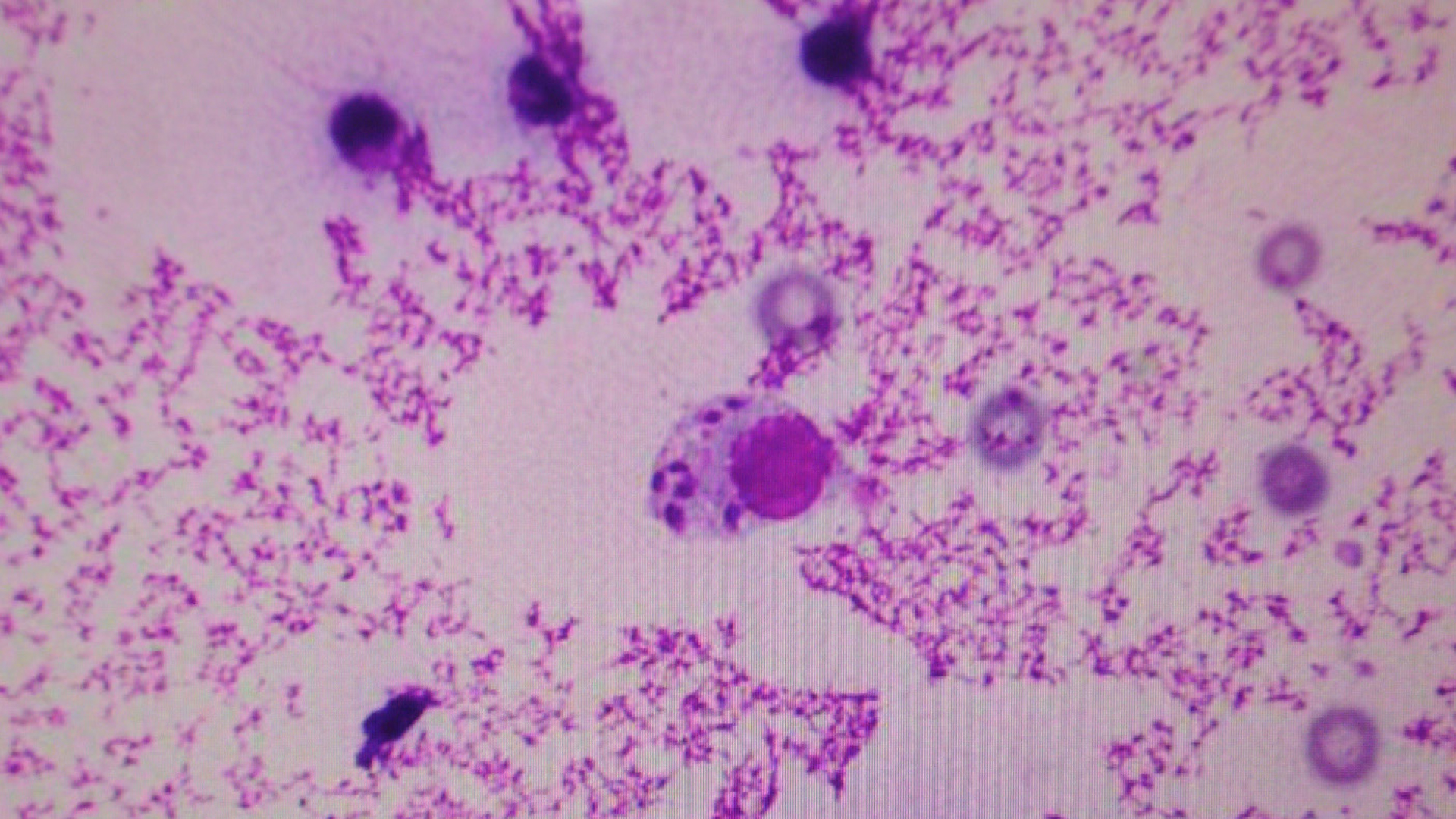
Der mikroskopische Erregernachweis (amastigote Form, Abb. 3) im Hautgeschabsel von Effloreszenzen sowie Lymphknoten-, Milz- und Knochenmarkaspiraten ist beweisend für eine Infektion. Der Erregernachweis in der Haut weist in der Frühphase der Infektion und bei Hunden ohne Symptome nur eine Sensitivität von weniger als 30 Prozent auf, diese steigt bei symptomatischen Tieren auf 75 Prozent. Die PCR steigert die Sensitivität und kann aus Blut, Harn, Ejakulat, Konjunktivaltupfern und Organaspiraten durchgeführt werden. Die Untersuchung von Blutproben zum Erregernachweis hat eine niedrigere Sensitivität und wird daher nicht so häufig zur Diagnose eingesetzt.
Ein Antikörpernachweis aus dem Serum zeichnet sich durch eine hohe Spezifität (96 Prozent) bei einer ebenfalls hohen Sensitivität bei symptomatischen Hunden (> 88 Prozent) aus, bei asymptomatischen Hunden reduziert sich die Sensitivität auf < 65 Prozent. In wenigen Fällen von Hunden mit klinisch manifester Leishmaniose wurden auch negative Antikörpertiter gemessen. Als Verfahren der Wahl zur Erstdiagnose kann derzeit der Erregernachweis aus z. B. Lymphknotenaspiraten oder Hautgeschabseln mit gleichzeitigem Antikörpernachweis bei symptomatischen Hunden angesehen werden. Für asymptomatische Hunde gelten prinzipiell dieselben Kriterien, jedoch sollte bei unklaren Testergebnissen eine Wiederholung nach drei bis sechs Monaten empfohlen werden.
Nach dem Import eines Hundes oder der Rückkehr eines reisebegleitenden Hundes sollte ein serologischer Screeningtest zweimal im Abstand von sechs Monaten durchgeführt werden, um die lange Zeitspanne einer möglichen Serokonversion zu berücksichtigen. Es werden immer wieder Hunde nach Österreich importiert, die mit einem negativen serologischen Testergebnis ankommen und erst einige Monate später serokonvertieren.

Therapie
Die derzeitige Standardtherapie der kaninen Leishmaniose erfolgt mit Allopurinol (10–15 mg/kg zweimal täglich oral). Eine mögliche Nebenwirkung ist die Entwicklung von Harngries und Xanthin-Harnsteinen, denen mit entsprechenden purinarmen Diäten begegnet werden kann. Sobald ein erhöhter Protein-Kreatinin-Quotient (UPC) im Harn vorliegt, ist es ratsam, eine Therapieerweiterung mit Meglumin-Antimonat (75–100 mg/kg s. c. einmal täglich für drei bis vier Wochen) oder Miltefosin (2 mg/kg einmal täglich oral über 28 Tage) zu starten. Als häufigste Nebenwirkung treten bei beiden Medikamenten gastrointestinale Symptome auf. Die aktuellen Therapieformen führen in der Regel nicht zur Erregerelimination. Bei renaler Hypertension oder einer verminderten glomuerulären Filtrationsrate muss zusätzlich eine unterstützende Nierentherapie eingeleitet werden.
Weitere Präparate wie Domperidon (0,5 mg/kg einmal täglich oral) oder das -Nahrungsergänzungsmittel Impromune® können zusätzlich zur Standardtherapie verabreicht werden. Das Antibiotikum Marbofloxacin (2 mg/kg einmal täglich oral über drei bis vier Wochen) zeigt ebenfalls eine positive Wirkung auf klinische Parameter bei Hunden mit Leishmaniose.
Zum weiteren Monitoring sind klinische Kontrollen und UPC-Analysen alle drei Monate sowie mindestens halbjährliche Kontrollen der relevanten Blutparameter anzuraten. Serologische Titerkontrollen sollten sechs Monate nach Start der Therapie und jederzeit beim Eintreten einer Verschlechterung des Allgemeinbefindens durchgeführt werden. Eine direkte Korrelation von Laborparametern und einer reduzierten Überlebenszeit beruht primär auf dem Vorhandensein einer Proteinurie, Hypoalbuminämie und Lymphopenie. Trotz aller therapeutischen Interventionen muss mit einer Letalitätsrate von 23 Prozent innerhalb der ersten zwei Jahre nach Diagnosestellung gerechnet werden.
Prophylaxe
Die Infektionsprophylaxe nimmt eine zentrale Stellung in der Epidemiologie der kaninen Leishmaniose ein. In Europa sind zwei Impfstoffe beim Hund zugelassen, die sich in der Anzahl der Grundimmunisierungen und des immunogenen Protein (gereinigte Leishmanien-Proteine bzw. rekombinantes Leishmanien-Protein Q) unterscheiden. Entscheidend ist hier nicht die Bildung von nachweisbaren Antikörpern, sondern eine Aktivierung der zellulären Immunantwort, die den Hund befähigt, den Erreger ohne Ausbruch klinischer Symptome zu eliminieren. Somit ist das Ziel der Impfungen nicht die Vermeidung der Infektion, sondern die Verhinderung des Krankheitsausbruches. Impfungen dürfen nur bei seronegativen und gesunden Hunden eingesetzt werden. Zusätzlich ist die Anwendung von insektiziden und repellenten Präparaten gegen die Sandmücken sinnvoll, die als Halsband oder Spot-on-Präparate appliziert werden. Bei reisebegleitenden Hunden ist ein spezifisches und individuelles Prophylaxekonzept gegenüber der kaninen Leishmaniose unbedingt notwendig.
Literaturliste
Bello de Vasconcelos, T. C., M. C. Furtado, V. S. Belo, F. N. Morgado und F. B. Figueiredo (2019): Canine susceptibility to visceral leishmaniasis: A systematic review upon genetic aspects, considering breed factors and immunological concepts. Infection, Genetics and Evolution 74: 103293.
Fernandez Cotrina, J., V. Iniesta, I. Monroy, V. Baz, C. Hugnet, F. Maranon, M. Fabra, L. C. Gomez-Nieto und C. Alonso (2018): A large-scale field randomized trial demonstrates safety and efficacy of the vaccine LetiFend® against canine leishmaniosis. Vaccine, 36, 1972–1982.
Fernandez M., M. D. Tabar, A. Arcas, C. Mateu, J. Homedes und X. Roura (2018): Comparison of efficacy and safety of preventive measures used against canine leishmaniasis in southern European countries: Longitudinal retrospective study in 1647 client-owned dogs (2012–2016). Veterinary Parasitology, 263, 10–17.
