Leiomyosarkom der Magenwand
beim Hund
Dr. Christina Dreier-Schöpf
Fachtierärztin für Kleintiere
ÖTK-Diplom Kleintieronkologin
Tierklinik Dreier-Schöpf
Ausgabe 12/2017
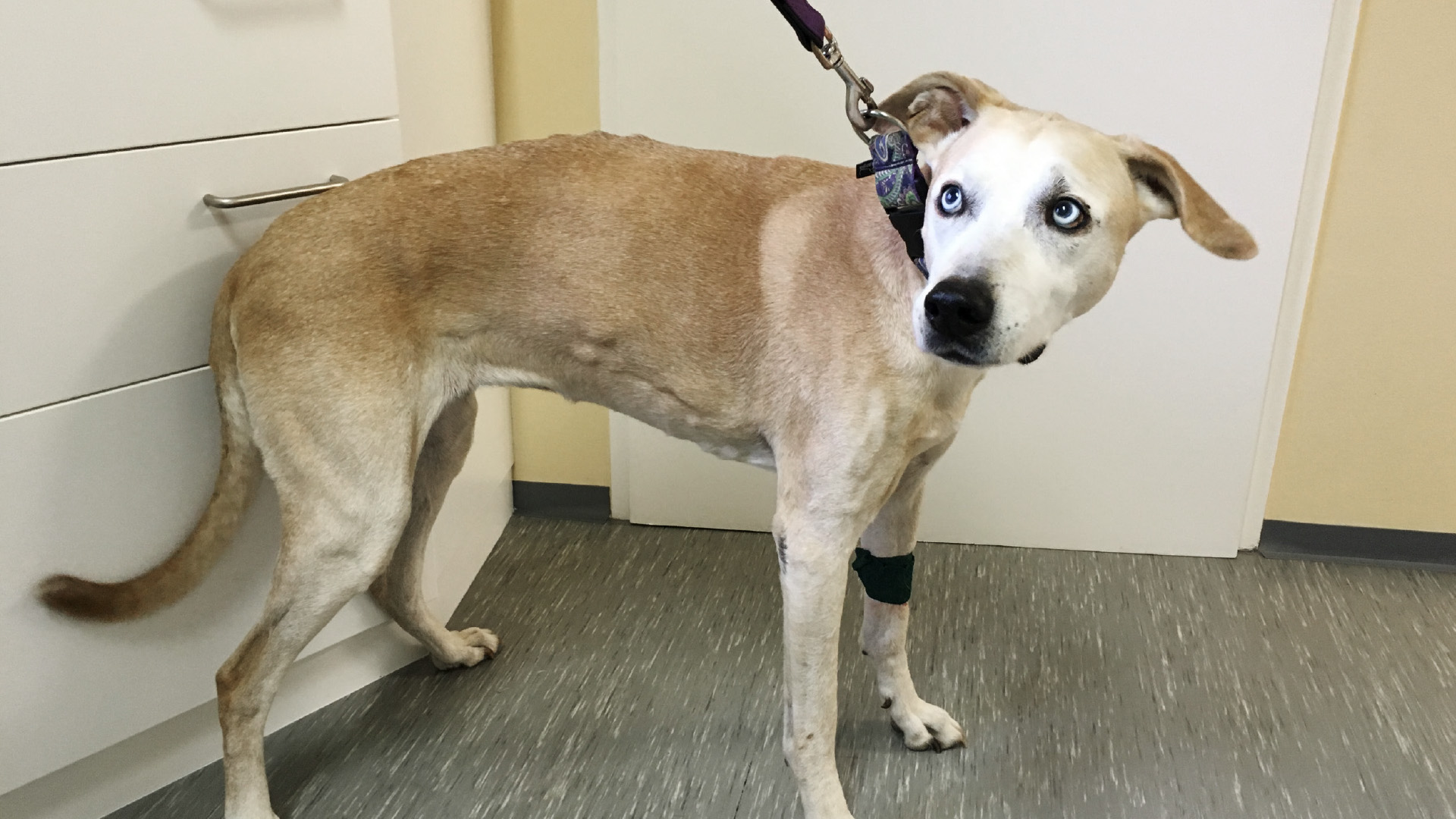
Magentumoren sind selten, daher gibt es nur verhältnismäßig wenig Literatur zu diesem Thema. Neoplasien des Magens machen nicht einmal ein Prozent aller Tumoren bei Hunden und Katzen aus.
EINLEITUNG
Am häufigsten handelt es sich bei Neoplasien des Magens um Adenokarzinome, gefolgt von Lymphomen und noch seltener um Leiomyosarkome. Letztere entwickeln sich aus der glatten Muskulatur, das Durchschnittsalter beträgt sieben bis zehn Jahre (Kessler 2013). Nach einer retrospektiven Studie wird von einer generell schlechten Prognose berichtet, wobei nur zwei von 21 Patienten ein Leiomyosarkom, alle anderen ein Adenokarzinom hatten (Swan, Holt 2002). Nach einer anderen Studie ist die Prognose nach Chirurgie bei Leiomyosarkomen der Magen- oder Darmwand exzellent, tritt dieses jedoch in der Leber auf, ist die Prognose sehr schlecht (Kapatkin et al. 1992).
FALLBERICHT – BESCHREIBUNG DES FALLES
Nationale:
Zum Zeitpunkt der onkologischen Erstvorstellung am 3. 10. 2015 ist die ovariohysterektomierte Mischlingshündin etwas mehr als zwölf Jahre alt (geboren am 1. 6. 2003), mit einem Gewicht von 28,4 kg, entsprechend einer Körper-oberfläche von 0,93 m². (In der Onkologie wird zur Dosisberechnung überwiegend die Körperober-fläche herangezogen, was eine genauere Dosisberechnung ermöglicht.)
Anamnese:
Die Hündin wird mit einer bereits im CT festgestellten und als inoperabel diagnostizierten abdominalen Umfangsvermehrung zur onkologischen Beratung und Therapie vorgestellt. Eine bislang nicht behandelte Herzinsuffizienz ist bereits bekannt. Den Tierbesitzern ist seit einiger Zeit Leistungsschwäche, der Unwille zum Springen ins Auto, ein generalisierter körperlicher Abbau und eine Zunahme des Bauchumfangs aufgefallen.
Klinische Untersuchung:
Zum Vorstellungszeitpunkt ist die Patientin ruhig und aufmerksam, der Ernährungszustand kachektisch bei erhaltener Hautelastizität. Die innere Körpertemperatur beträgt 38,6 °C, die Lidbindehäute sind beiderseits blass-rosa, ebenso die Maulschleimhaut. Die -Lymphknoten sind ohne Besonderheiten, der Puls mittelkräftig und unregelmäßig, die Arterie mittelgut gefüllt und mittelgut gespannt. Die Kapillarfüllungszeit beträgt drei Sekunden, die Atmung ist ohne Besonderheiten, ebenso die Auskultation der Lunge. Bei der Auskultation des Herzens ist ein systolisches Herzgeräusch über der Mitralregion sowie eine Arrhythmie feststellbar. Das Abdomen ist aufgrund einer gut fußballgroßen Umfangsvermehrung nur mäßig gut durchtastbar und die Hündin zeigt eine Schwäche in der Hinterhand. Bei der neurologischen Untersuchung liegen alle Ergebnisse im Bereich der Norm.
Problemliste:
Abdominale, gut fußballgroße Umfangsvermehrung, -systolisches Herzgeräusch über der Mitralregion, Arrhythmie, Schwäche in der Hinterhand und Kachexie.
CT-Befundbeschreibung:
CT-Untersuchungsstelle: Diagnostisches Zentrum für Kleintiere, Univ.-Doz. Dr. Wolfgang Henninger, Kienmayergasse 47/1, 1140 Wien, www.dzk.at. Im -Abdomen ist kein Hinweis auf freie Bauchhöhlenflüssigkeit zu finden. Eingekeilt in das ventrale Mesogastrium, ist eine ovoide höhergradige weichteildichte Raumforderung mit einer segmentalen Gefäßversorgung über eine Länge von 200 mm und einen Querschnitt von 160 × 80 bis 100 × 150 mm abzugrenzen; die Masse befindet sich in der Medianebene ventral der V. portae bzw. der Gefäße des Gekrösestammes, kaudal des Magens und medial der Milz und verdrängt den Großteil des Dünndarmkonvolutes nach links und kaudal. Alle in diesem Abschnitt befindlichen Nachbarorgane wie Leber, Milz, Magen und Pankreas haben unterschiedlich große Kontaktflächen mit möglichen Verlötungsarealen, vor allem ist die Grenzfläche über das ventrale Corpus pankreatis und entlang der Magenwand im Corpusabschnitt am wenigsten deutlich zu differenzieren. Auch im Epigastrium liegende Lymphknoten sind DD als Ausgangspunkt möglich. Die mittleren Dichtewerte der Masse liegen bei ggr. heterogen hypodenser Natur um +35 HE, nach KM-Gabe erreicht das Gewebe bei ebenso heterogenem Bild Werte um +50 bis 60 HE. Nieren und NN, die Harnblase sowie der kaudal verdrängte Dünndarm bilden sich entsprechend unauf-fällig ab.
An der Wirbelsäule sind deutliche Spondylosen/Spondylarthrosen im Abschnitt Th12/13 bis L3/4 zu sehen, Th13/13 und Th13/L1 sind zudem von niedrigen Pro-trusionen begleitet. Auch am lumbosakralen Übergang sind eine Spondylose und eine Engstellung der Neuro-foramina zu sehen.
Im Thorax sind am Lc. sternale zwei im Durchmesser 10 mm große Lymphknoten darzustellen. Am kontrastmarkierten Herzen fällt eine relative Weitstellung des Tr. pulmonalis und des rechten Herzens im Vergleich zu links auf. Beide Lungen sind normal belüftet und frei von pathologischen Rundschatten.
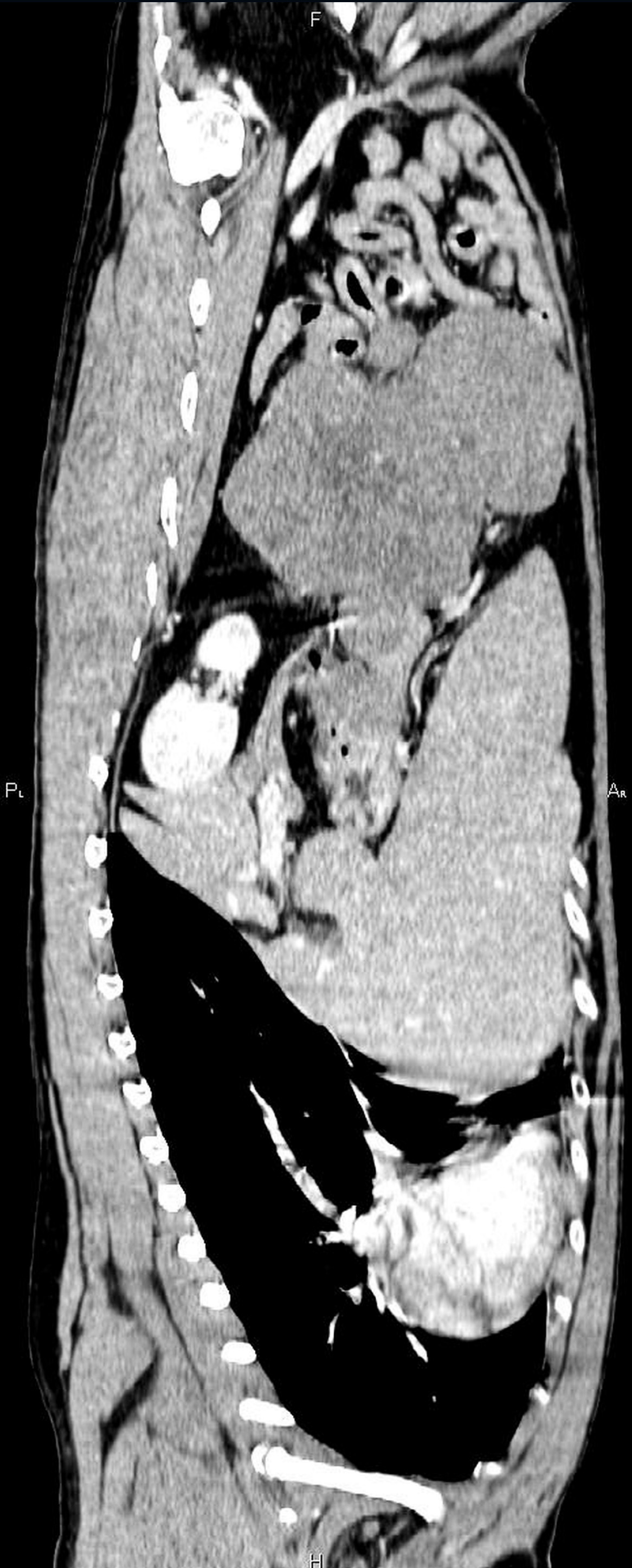
Differenzialdiagnosen für die abdominale Masse
Differenzialdiagnostisch kommen jegliche benigne wie maligne epitheliale, mesenchymale oder rundzellige Tumoren der inneren Organe oder Metastasen in diesen infrage. Aufgrund des Befundes der Computertomografie sind die vermutlichen Ursprungsorgane entweder das Pankreas, die Lymphknoten, der Magen, das Gekröse oder das Gefäßendothel.
Beginnend beim Pankreas als möglichem Ursprungs-organ, sind darin entstehende Tumoren meist malign. Sie gehen am häufigsten von duktalen oder azinären Zellen aus und sind entsprechend Adenokarzinome unterschiedlichen Differenzierungsgrades sowie mit hoher Metastasierungstendenz. Benign sind noduläre Hyperplasien oder Pankreasadenome, welche jedoch infiltrativ in die Duodenalwand wachsen können. Handelt es sich um einen Lymphknoten, dann ist die häufigste Ursache ein Lymphom oder eine Tumormetastase. Der Magen kommt als Ausgangsorgan generell sehr selten vor. Ist der Beginn dennoch dort zu suchen, dann findet man am häufigsten Adenokarzinome, gefolgt von Lymphomen und Leiomyosarkomen. Bei den benignen Tumoren sind es Leiomyome oder Adenome. Aber auch das Gekröse kann Ursprung einer solchen Masse sein, meist findet man hier jedoch Abklatschmetastasen von Tumoren benachbarter Organe oder auch primäre Sarkome oder Lipome. Liegen Hämangiome oder Hämangiosarkome vor, gehen diese meist vom Gefäßendothel aus, so wie Lymphangiome oder Lymphangiosarkome von Lymphgefäßen ausgehen (Kessler 2013).
Differenzialdiagnosen für das systolische Herzgeräusch über der Mitralregion und die Arrhythmie
Für das systolische Mitralgeräusch kommen als Differenzialdiagnosen die primäre Mitralklappeninsuffizienz durch erworbene degenerative Klappenveränderungen im Sinne einer chronisch degenerativen Mitralklappen-erkrankung (DMVD) oder erworbene entzündliche Klappenveränderungen infrage. Weiters die sekundäre Mitral-klappeninsuffizienz durch eine dilatative Kardio-myopathie, Verformung des Klappenringes durch eine hypertrophe oder restriktive Kardiomyopathie, Drucküberlastung der Klappen durch eine Aortenstenose oder durch eine arterielle Hypertension.
Bei der Arrhythmie unterscheidet man zwischen primären, kardial bedingten und sekundären Herzrhythmus-störungen. Letztere entstehen aufgrund unterschiedlicher Ursachen, die auf den Herzmuskel oder sein Reizleitungssystem einwirken und Rhythmusstörungen hervor-rufen. Mögliche Noxen sind dabei Endotoxine, Traumata, Zug am Zwerchfell und den großen Gefäßen sowie Sauerstoffmangel. Primäre Rhythmusstörungen treten am häufigsten im Rahmen des kongestiven Herzversagens auf. (Kresken, Wendt, Modler 2017; Neiger 2009)
Differenzialdiagnosen Kachexie
Für die Kachexie gibt es ebenfalls eine Fülle an Differenzial-diagnosen. Dies kann zum einen eine fütterungs-bedingt ungenügende Futteraufnahme sein, aber auch eine Aufnahmestörung oder Dysphagie, chronisches Erbrechen oder Regurgitieren, sowie Anorexie. Aber auch eine ungenügende Futterverwertung oder Malassimilation bei exokriner Pankreasinsuffizienz, Gallengangsobstruktion, Villusatrophie, IBD, GI-Lymphom, Leberinsuffizienz, Niereninsuffizienz, Hypoadrenokortizismus oder Durchfall kann Ursache für Kachexie sein.
Eine weitere Ursachengruppe stellt der Nährstoffverlust dar, durch Glukosurie bei Diabetes mellitus oder durch Proteinverlust über die Nieren, den Darm sowie bei chronischen Blutungen. Eine weitere Differenzialdiagnose ist der erhöhte Energieverbrauch bei pathologisch gesteigertem Metabolismus wie Hyperthyreose, Entzündungen oder Infektionen, Fieber, Tumoren, Trauma, Herzinsuffizienz bei physiologisch gesteigertem Metabolismus wie Trächtigkeit, Laktation, starker körperlicher Anstrengung oder erhöhter Wärmeproduktion (Neiger 2009).
Weiterführende Diagnostik
Als weiterführende Untersuchungen werden ein großes Blutbild und blutchemische Untersuchungen durch-geführt, deren Ergebnisse allesamt ohne Besonderheiten
sind. Im EKG zeigen sich kontinuierliche supraventrikuläre Extrasystolen.
Ultraschallgestützt werden zytologische Proben der Umfangsvermehrung entnommen, welche dominierend fischschwarmartige Zellen mesenchymalen Ursprungs zeigen. Das genaue Ursprungsgewebe lässt sich hieraus nicht erschließen.
Beratungsgespräch der Therapieoptionen
Chirurgie: Da trotz der Computertomografiediagnostik das Ursprungsorgan nicht eindeutig verifizierbar ist, stehen auch bezüglich der Operabilität einige Fragezeichen im Raum. Für einen so großen Pankreastumor zeigt die Patientin zu wenig klinische Symptome den Zuckerhaushalt betreffend. Auch liegt kein relevantes Problem beim Behalten des Futters oder der Verdauung vor, weshalb eine intraluminale Tumordurchsetzung des Magens sehr unwahrscheinlich erscheint.
Die Operation stellt eine sinnvolle Therapie dar, aller-dings mit erhöhtem Narkoserisiko aufgrund der supra-ventrikulären Extrasystolen.
Strahlentherapie: Ist wegen der möglichen Nebenwirkungen auf die umliegenden Bauchorgane und auf-grund der Größe des Geschehens nicht empfehlenswert. Ebenso besteht hier wie bei der Chirurgie ein deutlich erhöhtes Narkoserisiko.
Chemotherapie: Für eine primäre Chemotherapie ist die Masse bereits zu groß, zumal es sich auch noch um ein Sarkom handelt, welches per se auch ein deutlich geringeres Ansprechen auf Chemotherapie hat. Als adjuvante Therapie nach der Chirurgie ist die Chemotherapie jedoch als durchaus sinnvoll anzusehen.
Palliativtherapie: Aufgrund des fortgeschrittenen Stadiums und der zusätzlichen kardialen wie auch ortho-pädischen Probleme ist dies eine realistische Option zu den vorher genannten Maßnahmen.
Therapieentscheidung Chirurgie
Die Tierbesitzer entscheiden sich für die chirurgische Intervention und sind sich des erhöhten Narkoserisikos bewusst. Nach dem Ergebnis der pathohistologischen Untersuchung wäre auch die Option einer weiterführenden Chemotherapie für die Hundebesitzer mit erwachsenen Kindern im Haushalt eine Option. Sechs Tage nach der Erstvorstellung und der Diagnostik wird der chirurgi-sche Eingriff vorgenommen. Die Prämedikation erfolgt mit Methadonhydrochlorid 1 mg/kg, Acepromacin
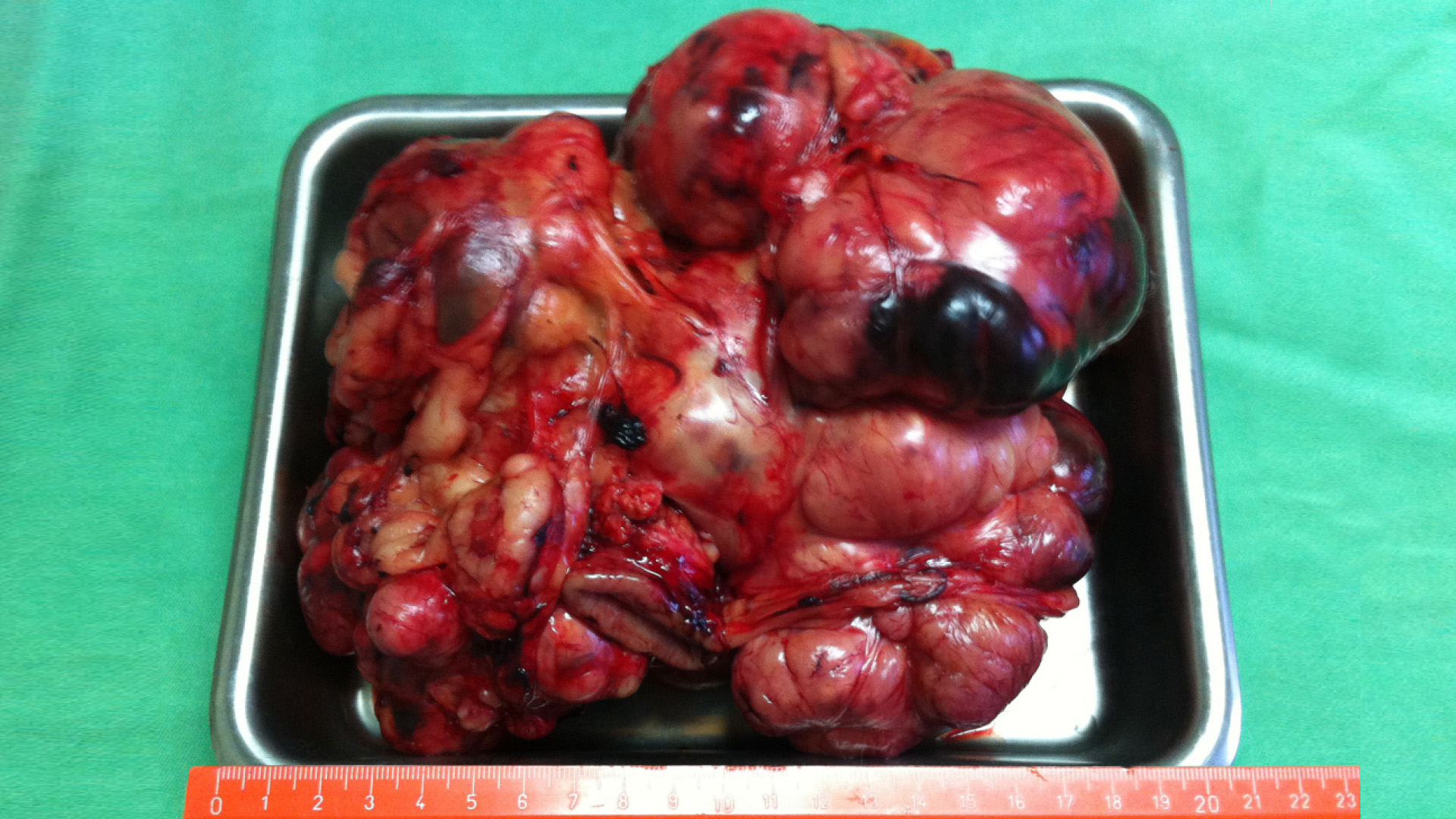
0,2 mg/kg und Atropinsulfat 0,02 mg/kg, die Inhalations-narkose nach Intubation mit Isoflurane. Als Antibiose wird Enrofloxacin 5 mg/kg SC und als Analgesie Meloxicam 0,2 mg/kg SC verwendet. Die i. v. Dauertropfinfusion kommt mit einer Tropfgeschwindigkeit von 1–1,5 Tropfen/kg/Minute zum Einsatz. Beim Operationsmonitoring werden kontinuierlich EKG, Blutdruck, Pulsoxymeter, Temperatur und Atemfrequenz kontrolliert. Trotz der massiven Extrasystolen ist keine akute Narkoseintervention nötig. Im Bedarfsfall wäre Lidocain 1–5 mg/kg langsam i. v. zum Einsatz gekommen. Chirurgisch kann eine 2,2 kg schwere Neoplasie der Magenwand mit Resek-tion im sichtbar gesunden Bereich des Magens entfernt werden. Verdächtige Tumorabklatschbereiche am Pankreas und im Gekröse werden mitentfernt und zur separaten pathohistologischen Beurteilung weitergeleitet. Unmittelbar nach der Entfernung der Masse kommt es zu einer deutlichen Reduktion der Extrasystolen.
Pathohistologie:
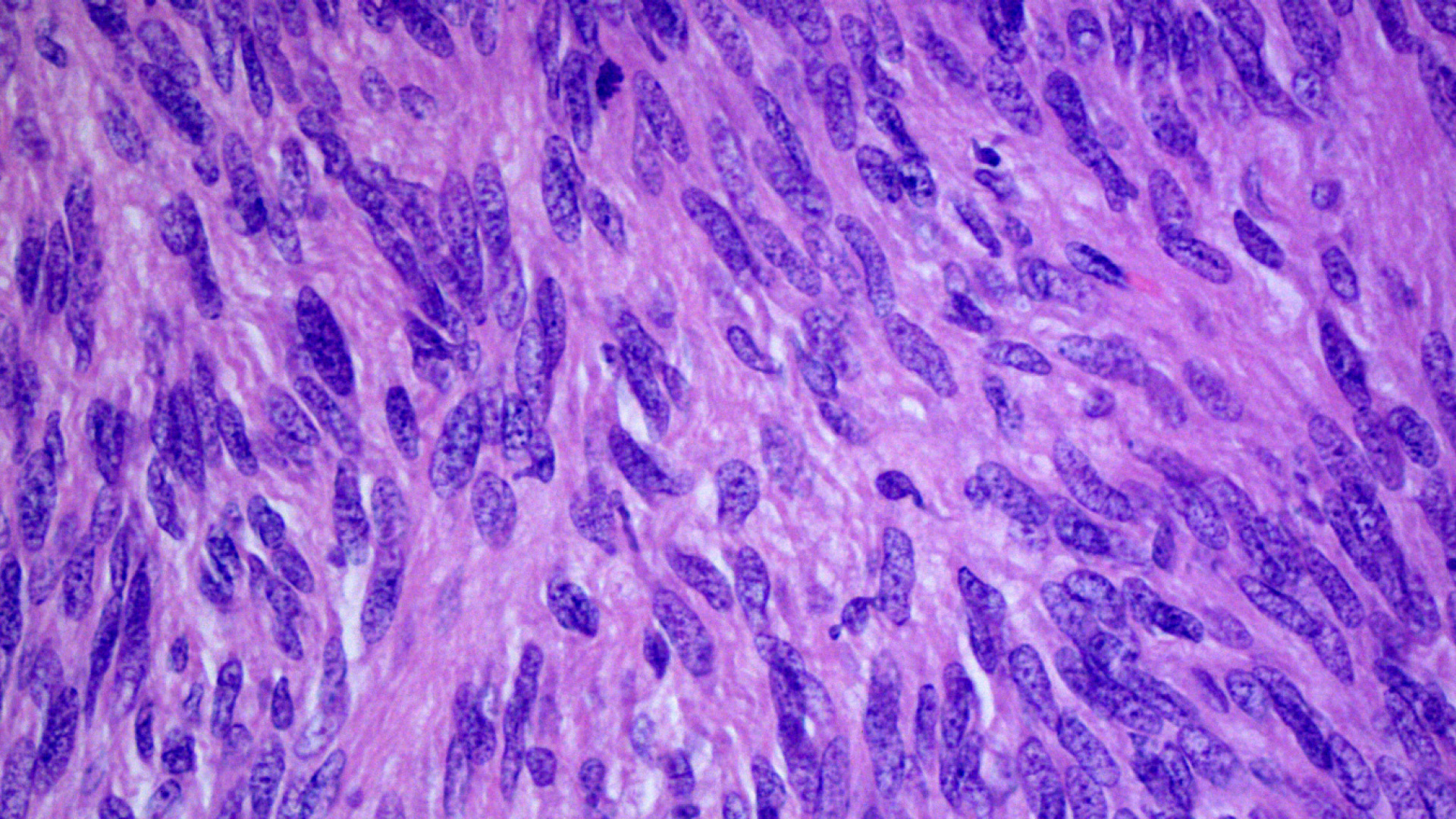
Die pathohistologische Untersuchung ergibt ein Leio-myosarkom der Magenwand. Weitere Sarkomzellen finden sich im Bereich des Gekröses zum Pankreas. Leio-myosarkome können rezidivieren, die Metastasierungs-gefahr ist als gering einzustufen.
Differenzialdiagnostisch muss in diesem Fall auch an einen gastrointestinalen Stroma-Tumor (GIST) gedacht werden, was nach Rücksprache mit den Pathohistologen noch weiter abgeklärt wird (Frost et al.). Frost et al. haben hierzu GIST und Leiomyome retrospektiv verglichen: Zu dieser Unterscheidung gibt es nach Durchsicht der Literatur noch einiges, speziell im pathohistologischen Bereich, zu überdenken. Denn gerade auch der mögliche Einsatz von Tyrosinkinase-Inhibitoren bei GIST ist ein wesentlicher Grund für die genauere Differenzierung dieser Tumoren, was auch aus der Arbeit von Dailey et al. sehr klar ersichtlich wird. Aus dieser Arbeit geht hervor, dass eine immunhistochemische Färbung zur Unterscheidung dieser beiden Entitäten notwendig ist. Eine positive Reaktion auf KIT (CD 117) wird als Goldstandard für die Diagnose eines caninen GIST angesehen.
Nach Dailey et al. 2015 wird DOG1 als hoch sensitiver und spezifischer Marker für humane GIST angesehen. In der genannten Studie wird dieser Marker auch für die Anwendung bei Hunden getestet. Nach Überprüfung von 55 Tumoren, die primär als mesenchymale gastrointestinale Tumoren differenziert worden sind, kommen die Untersucher zum Ergebnis, dass DOG1 eine noch verbesserte Spezifität und Sensitivität gegenüber KIT besitzt. Eine Kombination dieser beiden Marker, nämlich DOG1 und KIT IHC, erhöht die Aussagekraft diagnostischer Panels für canine GIST-Tumoren.
Im Zuge der Fallaufbereitung und der Literaturrecherche zeigt sich die Relevanz der immunhistochemischen Färbung zur Unterscheidung dieser beiden Entitäten, weshalb zu diesem Zeitpunkt noch eine Immunhistochemie beim Pathohistologen nachgefordert wird. Im Falle dieser Patientin ist CD 117 negativ, jedoch SMA (immunhistochemischer Nachweis glatter Muskulatur) positiv, was nun eindeutig das Leiomyosarkom bestätigt.
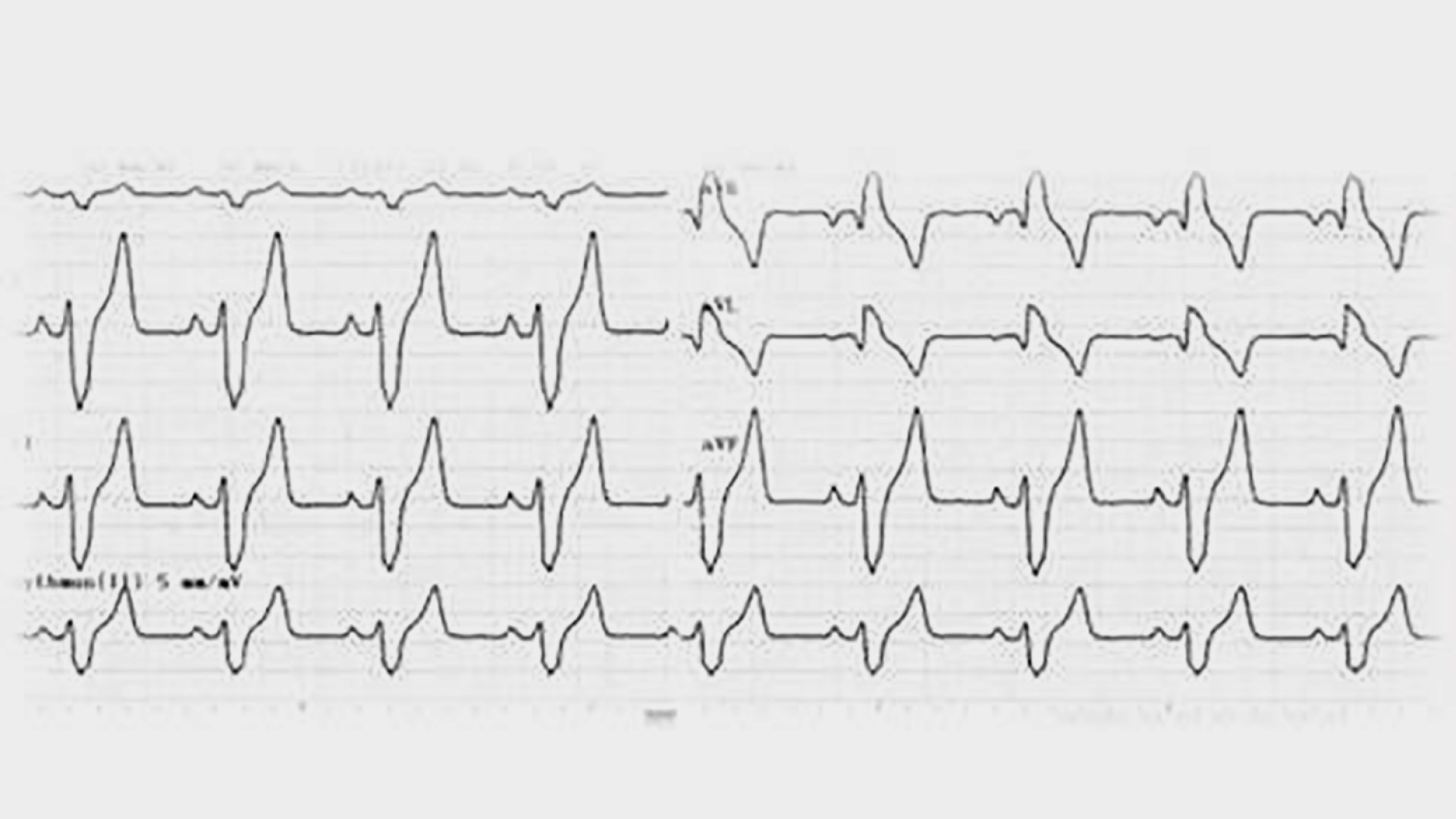
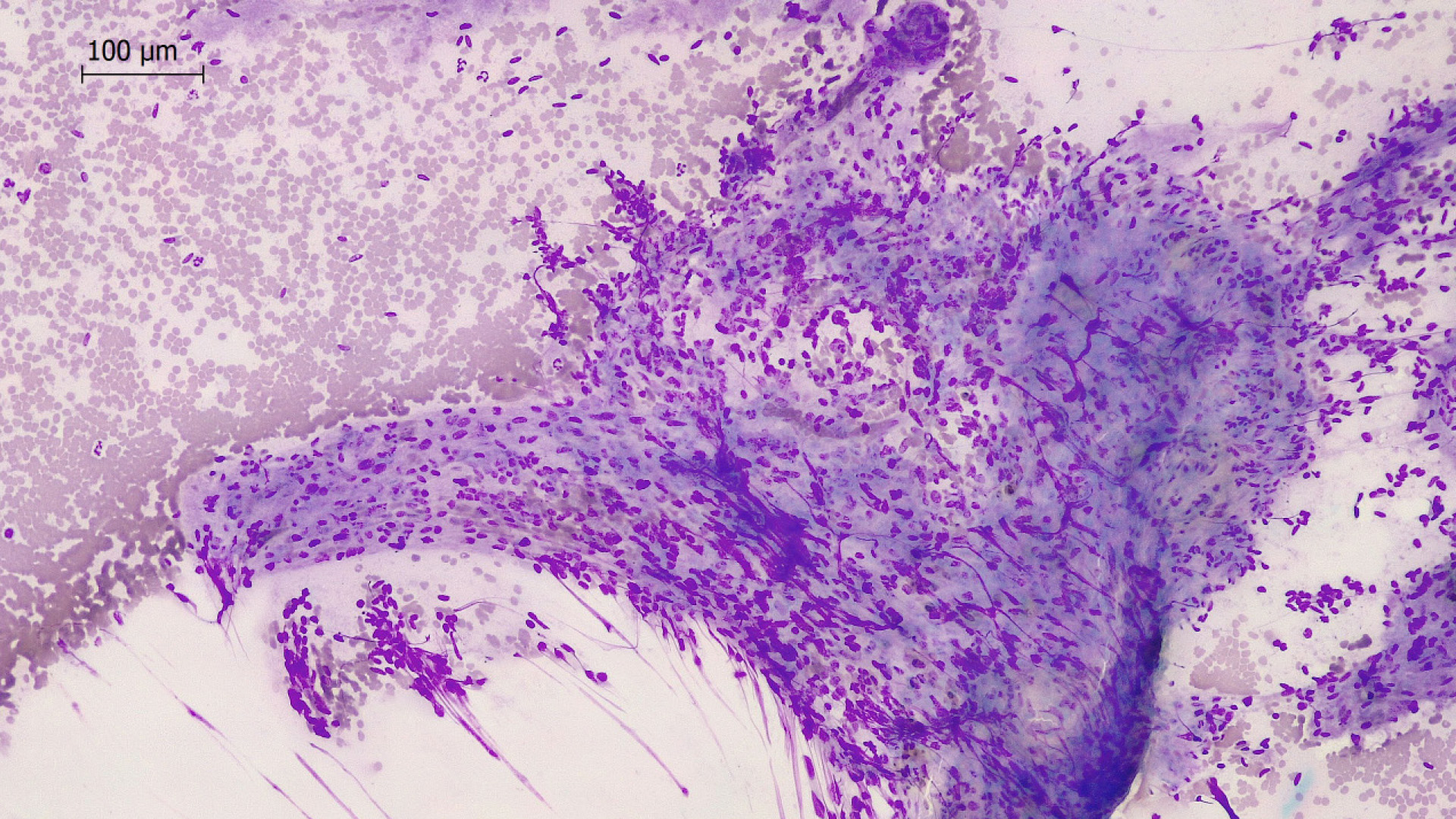
Weiterführende Therapie des Leiomyosarkoms
Chemotherapieanwendung nach VÖK-VONA Standards: Aufgrund der nachgewiesenen Sarkomzellen im Gekröse erfolgt die Empfehlung einer adjuvanten Chemothe-rapie mit je zweimal Doxorubicin 30 mg/m² und Carboplatin 300 mg/m² im Wechsel alle vier Wochen (28. 10. 2015 Doxorubicin, 25. 11. 2015 Carboplatin, 30. 12. 2015 Doxorubicin, 27. 1. 2016 Carboplatin). Nach Besitzer-ermessen soll Maropitant 60 mg einmal täglich in den ersten sechs Tagen nach Verabreichung der Chemotherapie zur Antiemesis verabreicht werden. Jedoch benötigt die Patientin an keinem Tag ein Anitemetikum. Vor jeder neuen Therapie erfolgt eine Blutuntersuchung mit Hämatologie und Blutchemie, die jeweils im Normbereich liegt. Besitzeraufklärung und Chemotherapie-Verab-reichung werden entsprechend den VÖK-VONA-Standards durchgeführt:
1. Schutz der Tierbesitzer: Die Halter werden darüber aufgeklärt, dass geringe Mengen des Medikaments über Kot und Erbrochenes sowie sehr geringe Mengen über den Harn ausgeschieden werden. Daher sollen in den ersten drei bis vier Tagen nach der Therapie Exkremente und Erbrochenes mit Einmalhandschuhen und „Gackerl-sackerl“ eingesammelt und über den Restmüll entsorgt werden. Schwangere, stillende Mütter und Kinder sollen die Reinigung in dieser Zeit nicht vornehmen, ebenso sollen krabbelnde Kleinkinder keinen direkten Kontakt mit
dem behandelten Patienten haben. Gemeinsame Wiesen sollen nicht für den Kot- und Harnabsatz benützt werden. Gleichzeitig bekommen die Tierbesitzer aber auch zu bedenken, wie viele Menschen Chemotherapie bekommen, denen solche Richtlinien niemals gesagt werden, wenn es um Kontakt mit Familienangehörigen oder Menschen in ihrem Umfeld geht.
2. Schutz der tierärztlichen Mitarbeiterinnen und Mitarbeiter sowie Eigenschutz: Dieser erfolgt durch die ausschließliche Anwendung von geschlossenen Systemen von Oncoprotect® oder speziellen Überleitungssystemen wie z. B. PhaSeal®, durch doppelte Handschuhe, Schutzbekleidung und durch exakt festgelegte Arbeitsabläufe. Die Verabreichung der Chemotherapien erfolgt in einem separaten Raum, der etwas abseits vom Hauptklinikbereich liegt und eine ruhige Atmosphäre für den zu behandelnden Patienten bietet. Für den hoffentlich nie eintretenden Ausnahmefall des Austritts von Chemotherapeutikum in die Umgebung muss in unmittelbarer Nähe zum Anwendungsbereich immer ein onkologi-sches Reinigungsset aufbewahrt werden, das mit einem Griff erreichbar ist. Natronlauge und 96-prozentiges Ethanol müssen als Reinigungsmittel vorhanden sein. Die -wichtigste Vorbereitung auf den Zwischenfall ist die Einhaltung der Arbeitsabläufe, um es erst gar nicht zum Zwischenfall kommen zu lassen. Die Verabreichung der Chemotherapie erfolgt ohne Besitzeranwesenheit, da wir uns im Falle von austretendem Chemotherapeutikum nicht nur um den Patienten und uns, sondern auch noch zusätzlich um die medizinische Versorgung der Besitzer kümmern müssten.
3. Patientenschutz: Beim Setzen des Venenkatheters muss darauf geachtet werden, dass dieser mit dem ersten Stich sitzt. Die Nadel darf weder durchgestochen und wieder zurückgezogen werden, noch darf an einer „verstochenen“ Extremität am selben Tag nochmals gestochen werden. All diese Vorgänge können zu einer Paravasation, dem Austreten von Chemotherapeutikum ins umliegende Gewebe, führen, und bereits kleine Mengen können einen sehr großen Gewebsdefekt verursachen. Vor der Verabreichung des Chemotherapeutikums muss die Sicherheit des Venenzugangs immer mit ausreichend physiologischer Kochsalzlösung überprüft werden. Für den Fall der Fälle müssen spezielle Paravasate-Sets immer bereitstehen. Da bei verschiedenen Substanzen unterschiedliche Maßnahmen zu ergreifen sind, muss die von VÖK-VONA und Oncoprotect herausgegebene Tabelle immer im onko-logischen Behandlungsraum aufliegen, um im Bedarfsfall auch die richtigen Schritte setzen zu können. Begleit-therapie während und nach der Chemotherapie: Firocoxib
5 mg/kg SID als COX-2-Inhibitor zur Förderung der Apoptose und zur Reduktion der Angiogenese, Coenzym compositum® Heel zweimal wöchentlich eine Ampulle, PO + Ubichinon compositum® Heel zweimal wöchentlich eine Ampulle, PO + Parabenzochinon-Injeel® Heel einmal wöchentlich zwei Ampullen, PO als Biokatalysatoren sowie Docosahexaensäure – Omega 3 DHA® als mehrfach ungesättigte Fettsäuren mit entzündungshemmenden Eigenschaften.
Abschlussbeurteilung
Die zum Diagnosezeitpunkt etwas über zwölfjährige, hochgradig kachektische Hündin mit massiven Bewegungs-problemen ist zum Abgabezeitpunkt dieses Fallberichtes
bei bester Lebensqualität und inzwischen etwas über 14 Jahre alt. Die Hündin hat binnen kürzester Zeit wieder Gewicht zugenommen (inzwischen 29,4 kg) und zeigt keine Bewegungsprobleme mehr. Die Arrhythmien sind vollständig verschwunden, das systolische Herzgeräusch über der Mitralregion ist zwar weiterhin vorhanden, die Hündin ist bis heute asymptomatisch. Die Hündin ist aufgeweckt und genießt das Leben im Familienverband.


Literatur
Kessler M. (Hrsg.): Kleintieronkologie, 3. Auflage 2013, Enke Verlag in MVS GmbH
Kresken JG, Wendt RT, Modler P (Hrsg.), Praxis der Kardiologie Hund und Katze,
1. Auflage 2017, Enke Verlag in Georg Thieme Verlag KG
Neiger R. (Hrsg.): Differenzialdiagnosen Innere Medizin bei Hund und Katze,
3. Auflage 2009, Enke Verlag in MVS GmbH
Withrow S. J., Vail D. M., Page R. L. (Hrsg.): Withrow & Mac Ewan’s Small Animal
Clinical Oncology, 5th edition, Saunders, an imprint of Elsevier Inc., 2013
Fossum T. W.: Chirurgie der Kleintiere, 1. Auflage in dt. Übersetzung, Elsevier Health Sciences 2007
Baumgärtner W.: Pathohistologie für Tiermedizin, 2. Auflage, Enke Verlag 2012
David T., Kasper I., Kasper M.: Atlas der Kleintierchirurgie, 2. Auflage, Schlütersche 2008
Dobson J. M., Lascelles B. D. X.: BSAVA Manual of Canine and Feline Oncology, Third Edition, BSAVA 2011
Frost et al.: Gastrointestinal Stromal Tumors and Leiomyomas in the dog: a histopathologic, immunohistochemical and molecular genetic study of 50 cases, 2003, Vet Pathol. 40:1
Dailey D. D. et al.: DOG1 is a sensitive and specific immunohistochemical marker for diagnosis of canine gastrointestinal tumors, Journal of Veterinary Diagnostic
Investigation, 2015, Volume: 27 issue: 3, page(s): 268–277
