Kritische Antibiotika -
Aktuelle Herausforderungen
Univ.-Prof. Dr. med. vet. Annemarie Käsbohrer
Leiterin des Instituts für Öffentliches Veterinärwesen, Vetmeduni Vienna
Ausgabe 01/2017

Die therapeutische Wirksamkeit von Antibiotika muss erhalten bleiben.
Antibiotikaresistenzen sind ein globales Problem mit Bedeutung für die Human- und Veterinärmedizin. Um die Ausbreitung der Resistenzentwicklung einzudämmen und den Selektionsdruck auf Bakterien zu minimieren, müssen Human- und Veterinärbereich gemeinsame Anstrengungen zur Reduzierung des Einsatzes von Antibiotika unternehmen.
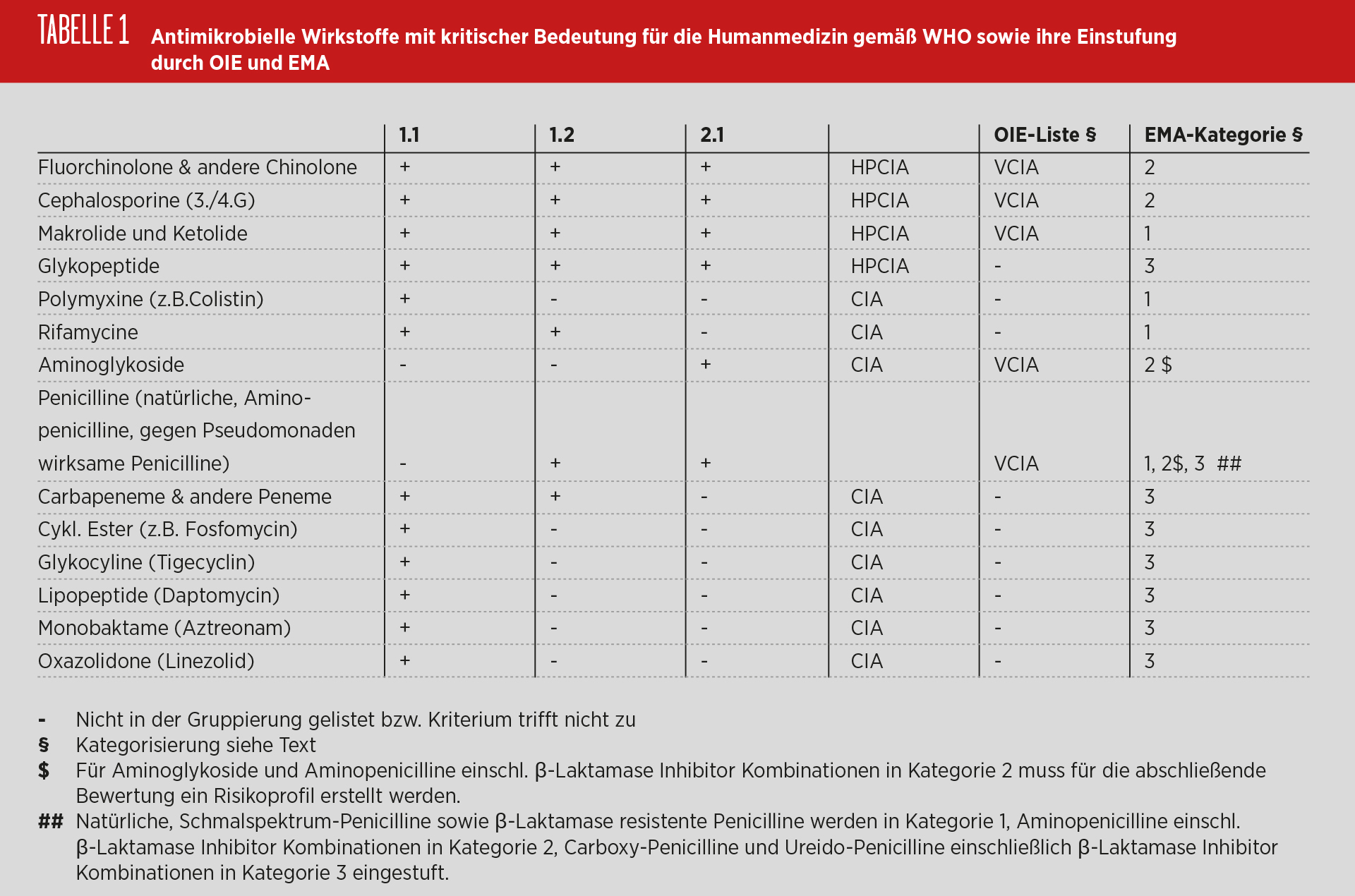
Die Weltgesundheitsorganisation (WHO) bewertet Antibiotika entsprechend ihrer Bedeutung für die Therapie von Infektionen beim Menschen nach zwei Kriterien: (1) Es handelt sich um einen antimikrobiellen Wirkstoff, der allein oder mit wenigen anderen Optionen für die Therapie von schweren Infektionen des Menschen verfügbar ist; (2) der antimikrobielle Wirkstoff wird zur Behandlung von Infektionen genutzt, die entweder durch Erreger verursacht wurden, die auf den Menschen von anderen nicht-humanen Quellen übertragen werden können oder durch Erreger, die Resistenzgene von nicht-humanen Quellen erwerben können. Treffen beide Kriterien auf den antimikrobiellen Wirkstoff zu, werden sie als „critically important antimicrobials“ (CIA) eingestuft [WHO, 2012].
Für eine weitere Gewichtung innerhalb der CIAs wurde für Kriterium 1 berücksichtigt, (1.1) ob eine hohe Anzahl an Erkrankungsfällen des Menschen betroffen ist und (1.2) ob der Wirkstoff häufig beim Menschen eingesetzt wird. Für das Kriterium 2 wurde zusätzlich berücksichtigt, (2.1) ob es eine hohe Evidenz gibt, dass eine Übertragung der Keime oder Resistenzgene aus nicht-humanen Quellen stattfindet. Wirkstoffe, die zusätzlich diese Kriterien erfüllen, werden als „highest priority critically important antimicrobials“ (HPCIA) eingestuft, d. h., Maßnahmen des Risikomanagements sind am dringendsten geboten (Tabelle 1). Zu dieser Gruppe der HPCIA zählen die auch in der Veterinärmedizin zugelassenen Antibiotikaklassen der Makrolide, Fluorchinolone und der Cephalosporine der dritten und vierten Generation sowie die nur in der Humanmedizin zugelassenen Glykopeptide. Diese Wirkstoffklasse wurde gelistet, da Avoparcin bei Enterokokken Vancomycin-Resistenzen selektiert hatte.
Von der Weltgesundheitsorganisation für Tiere (Office International des Epizooties; OIE) wurde eine Liste der für die Veterinärmedizin besonders wichtigen Antibiotikaklassen (veterinary critically important antimicrobial agents, VCIA) verabschiedet [OIE, 2015]. Der Vergleich der OIE- und WHO-Liste im Jahr 2007 zeigte für mehrere Wirkstoffklassen Überlappungen. Dies betraf neben den HPCIA auch die Penicilline und Aminoglykoside [FAO/WHO/OIE, 2007].
Für die Abschätzung der Bedeutung von Antibiotika-?anwendungen bei Nutzieren für die Tier- und Human-gesundheit sowie möglicher Management-maßnahmen wurden von der EMA Expertengruppe (Antimicrobial Advice ad hoc Expert Group; AMEG) drei Kategorien identifiziert [EMA, 2014]. Auf der Grundlage der WHO-Liste für CIA wurden die Wirkstoffe in drei Kategorien eingeteilt. Antimikrobielle Wirkstoffe mit Anwendung in der Veterinärmedizin mit geringem bzw. begrenztem Risiko für die Humangesundheit (Kategorie 1) wurden von solchen mit höherem Risiko (Kategorie 2) und solchen, die für die Anwendung in der Veterinärmedizin nicht zugelassen sind (Kategorie 3), unterschieden.
Für die Bewertung der Wahrscheinlichkeit einer Resistenz-?ausbreitung wurden herangezogen: (a) vertikale Über-tragung von Resistenzgenen von einer Generation zu der nächsten Bakteriengeneration, (b) Übertragung von Resistenzgenen über mobile genetische Elemente, z.B. Plasmide, (c) Co-Selektion von Resistenz, (d) Potenzial für die Übertragung von Resistenzen durch Zoonoseerreger oder kommensale Keime aus der Lebensmittelkette, (e) Evidenz für Ähnlichkeit von Resistenzgenen, mobilen genetischen Elementen und/oder resistenten Keimen. In der aktuellen Diskussion und Darstellung von Daten wird meist Bezug genommen auf die HPCIA-Liste der WHO mit Stand 2012, teilweise werden auch nur explizit Fluorchinolone und Cephalosporine der dritten und vierten Generation, aber nicht Makrolide, berücksichtigt.
Welche Mengen der kritischen Antibiotika werden in der Veterinärmedizin eingesetzt?
Vertriebsmengen 2014 in der EU/EEA
In der Europäischen Union (EU) / European Economic Area Region (EEA) und der Schweiz (insgesamt 29 Länder) wurden im Jahr 2014 insgesamt 9.009,5 Tonnen antimikrobielle Wirkstoffe verkauft [EMA, 2016a]. Umgerechnet auf das Gewicht des Tierbestandes und der geschlachteten Tiere, bereinigt um Im- und Exporte (dargestellt als population correction unit, PCU), betrug die durchschnittliche Menge 158,24 mg/PCU, für Österreich 56,3 mg/PCU.
Die durchschnittlichen Anteile der Verkaufsmenge (bezogen auf alle 29 Länder und mg/PCU) der einzelnen Wirkstoffklassen betrugen für die HPCIA knapp 10%. Makrolide machten mit 7,5% den größten Anteil aus. Der Anteil der HPCIA betrug für Österreich 9,9%.
Vertriebs- und Abgabemengen im Jahr 2015 in Österreich
Im Jahr 2015 wurden in Österreich 48,78 Tonnen verkauft, was einer Reduktion um 9,1% entspricht. Hierbei machten die HPCIA 4,61 Tonnen (9,5%) aus. Der Hauptanteil waren Makrolide, gefolgt von Fluorchinolonen. Bezogen auf die Menge wurden in 2015 geringfügig mehr Fluorchinolone und Cephalosporine, aber weniger Makrolide vertrieben [AGES, 2016b].
Der Auswertung der Abgabemengen der Tierärztlichen Hausapotheken (HAPO) gemäß Veterinär-Antibiotika-MengenströmeVO liegen die Angaben von 599 von 1.666 HAPO zugrunde. Sie umfasst ca. 80% der Vertriebsmenge [AGES, 2016b]. Rund drei Viertel (75,8%) der rund 39 Tonnen wurden für die Tierart Schwein abgegeben, gefolgt von Rind (17,1%) und Geflügel (6,8%). Bezogen auf die PCU wurden 79,2 mg/PCU Schwein, 15,3 mg/PCU Rind sowie 33,8 mg/PCU Geflügel abgegeben.
Innerhalb der HPCIA wurde die größte Menge Fluorchinolone für Schweine, gefolgt von Geflügel abgegeben. Dies machte für Schweine 0,3%, für Rinder 0,75% und für Geflügel 2,6% der gesamten Abgabemenge an die jeweilige Tierart aus. Die größte Menge der Makrolide wurde für die Anwendung beim Schwein, gefolgt von Geflügel abgegeben. Beim Geflügel machte diese Wirkstoffklasse 34,8% der insgesamt für Geflügel abgegebenen Menge aus. Die Abgabe von Cephalosporine der dritten und vierten Generation wurde für alle drei Tierarten berichtet, wobei der Anteil bei Rindern am höchsten war. Polymyxine wurden insbesondere zur Anwendung bei Schwein und Geflügel abgegeben. Beim Geflügel machte diese Wirkstoffgruppe mit 19,85% den zweithöchsten Anteil der Abgabemenge aus.
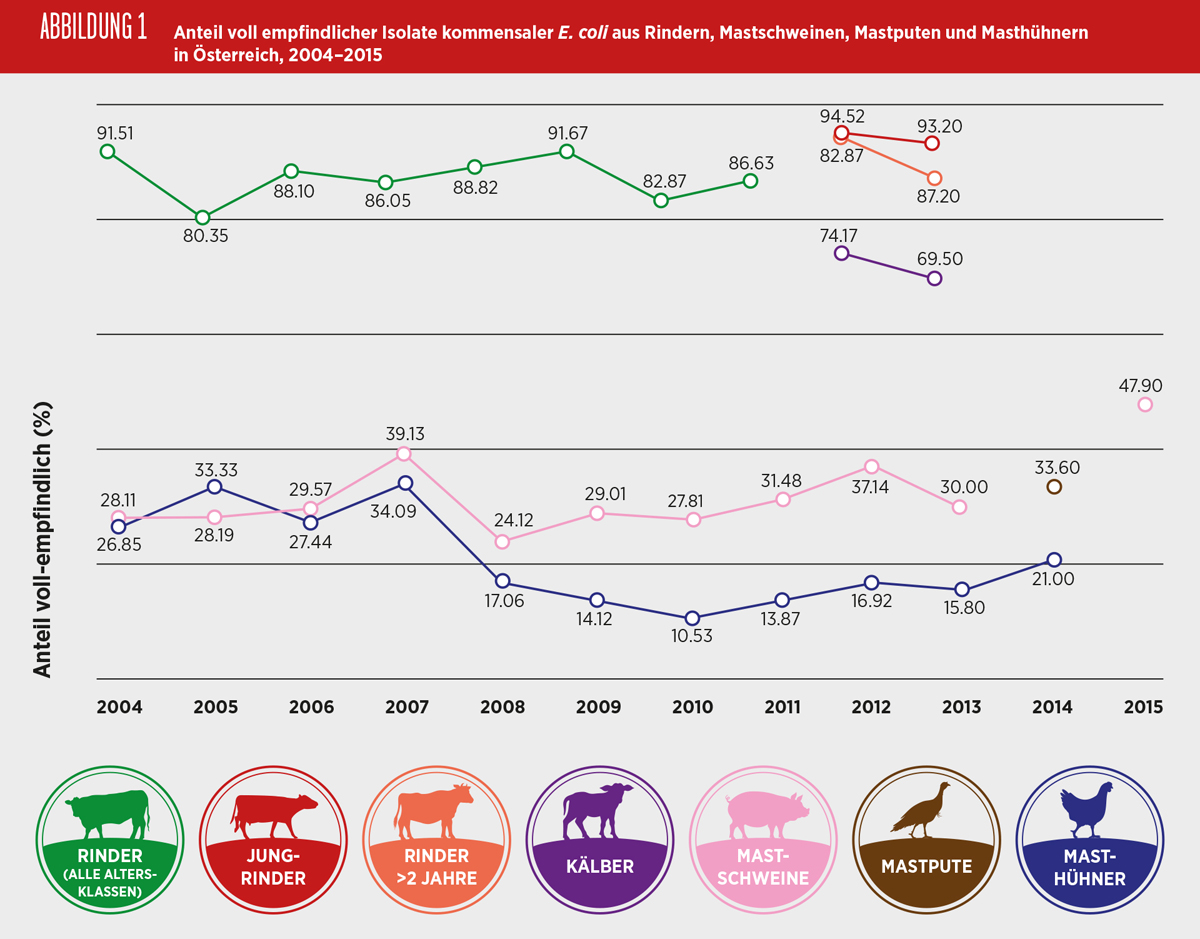
Resistenzen gegen kritische Antibiotika in der EU
Zur Durchführung des Resistenzmonitorings gemäß Kommissionsbeschluss (2013/652/EU) [KOM, 2013] werden jährlich repräsentative Stichproben gezogen und auf Zoonoseerreger bzw. kommensale E. coli untersucht [AGES, 2016a]. Für die Resistenztestung kommt seit 2014 ein erweitertes Wirkspektrum zur Anwendung, um auch Risiken bezogen auf HPCIA und CIA besser abschätzen zu können (Tabelle 2).
Campylobacter
In der Europäischen Union zeigten im Jahr 2014 Campy-lobacter (C.) jejuni bzw. C. coli von Masthühnern im Durchschnitt hohe Resistenzraten gegen (Fluor)chinolone (Ciprofloxacin 69,8% bzw. 74,3%; Nalidixinsäure 65,1% bzw. 69,5%). Diese Situation spiegelte sich bei Isolaten von Mastputen sowie aus Hühner- und Putenfleisch wider, wobei die Resistenzraten bei C. coli zum Teil deutlich höher waren [EFSA u. ECDC, 2015].
Resistenzen gegen Erythromycin (Makrolid) wurden im Durchschnitt bei 5,9% der C. jejuni Isolate von Masthühnern nachgewiesen. Bei Mastputen und Hühnerfleisch lagen die Resistenzraten niedriger (2,5% Mastputen, 1,9% Hühnerfleisch). Bei C. coli waren die Erythromycin-Resistenzraten durchweg höher, am häufigsten wurde diese Resistenz bei Mastputen mit 43,3% beobachtet (14,5% Masthühner, 17,2 % Hühnerfleisch). Diesem Befund kommt eine besondere Bedeutung zu, da inzwischen auch für die Erythromycin-Resistenz ein übertragbares Resistenzgen beschrieben wurde.
E. coli
Wie bereits auf europäischer Ebene beschrieben, werden auch in Österreich bei E. coli am häufigsten Resistenzen gegen Fluorchinolone bei Masthühnern beobachtet. Bei Mastschweinen lag diese Rate deutlich niedriger im Vergleich zum Geflügel. Resistenzen gegen Cephalosporine der dritten Generation konnten bei Masthühnern, Mastputen und Mastschweinen in geringem Umfang nachgewiesen werden. Resistenzen gegen das Makrolid Azithromycin wurden in geringem Umfang bei beiden Geflügelspezies, aber nicht beim Schwein, gefunden. Eine Resistenz gegen Colistin wurde nur bei Isolaten vom Schwein nachgewiesen. Resistenzen gegen Carbapeneme und Glycylcycline wurden in den Programmen in 2014 und 2015 nicht beobachtet.
Bei dem selektiven Monitoring auf ESBL/AmpC-bildende Keime, das erstmals im Jahr 2015 verpflichtend durchgeführt wurde, konnte das Vorkommen von ESBL/AmpC-bildenden E. coli bei 52,1% der Proben vom Schwein (Blinddarminhalt), 9,0% der Proben vom Schweinefleisch, und 3% der Proben von Rindfleisch bestätigt werden [AGES, 2016a].
Werden die Ergebnisse der Resistenztestung dieser per definitionem Cephalosporin-resistenten Isolate betrachtet, so deutet sich an, dass auch im Rinderbereich Resistenzen gegen HPCIA und CIA vorkommen können. Bei einem ESBL/AmpC-bildenden E. coli vom Schwein wurde das Colistinresistenzgen mcr-1 nachgewiesen. Dies deckt sich mit Ergebnissen aus Deutschland. Auch dort waren vom Schwein nur zu einem geringen Anteil mcr-1 bei Colistin-resistenten Isolaten nachgewiesen worden [Irrgang et al., 2016]. Allerdings wurden in dieser Studie im Unterschied zu Österreich bei Geflügel deutlich häufiger eine Colistinresistenz und das mcr-1 Gen nachgewiesen.
Ausblick
Die Kategorisierung von Antibiotikaklassen entsprechend ihrer Bedeutung für die Therapie des Menschen hilft, Prioritäten bei der Umsetzung von Reduktions- und Begrenzungsmaßnahmen zu setzen. Die aktuellen Entwicklungen zeigen aber auch, dass eine Fokussierung auf HPCIA möglicherweise zu eng ist. Das Auftreten einer übertragbaren Colistinresistenz führte seitens der EMA zu der Empfehlung, den Einsatz von Colistin möglichst weitgehend zu reduzieren (EMA, 2016b). Die Ausbreitung von Carbapenem-Resistenzen in der Humanmedizin und die sporadische Beschreibung solcher Resistenzen in Tierbeständen (Fischer et al., 2016) macht deutlich, dass auch Resistenzen gegen Wirkstoffklassen, die nicht in der Veterinärmedizin zugelassen sind, ein Problem darstellen können. Aber auch die Verbreitung von Methicillin-resistenten Staphylococcus aureus muss im Blick bleiben. Dies verdeutlicht eine kürzlich veröffentlichte Studie, die Hinweise auf einen Zusammenhang zwischen CC9/CC398 Isolaten von Menschen ohne Tierkontakt und Isolaten aus Putenfleisch aufzeigte (Fetsch et al., 2016).
Verbesserungen
Die zunehmend verfügbaren Daten helfen, Empfehlungen bzgl. der Bekämpfungsmaßnahmen zu verbessern und die Durchführung solcher Aktionen zu begleiten und zu bewerten. Landwirtschaftliche Betriebe zusammen mit ihren betreuenden Tierärzten sind gefordert, geeignete Maßnahmen zur Verbesserung der externen und internen Biosicherheit zu ergreifen. Sie müssen insbesondere das Ziel verfolgen, die Tiergesundheit zu sichern bzw. zu erhöhen. Nur so kann weitgehend auf den Einsatz von Antibiotika verzichtet werden. Die derzeitige Situation erfordert, dass HPCIA nur in begründeten Ausnahmefällen eingesetzt werden und dass insgesamt der Einsatz von Antibiotika auf das unbedingt notwendige Maß reduziert wird [EMA, 2016b].
Zusammenfassung
Resistenzen gegen besonders wichtige Antibiotikaklassen, wie z.B. Fluorchinolone und Cephalosporine, sind weit verbreitet. Eine Ausbreitung von Resistenzen gegen andere in der Humanmedizin therapeutisch besonders wichtige Wirkstoffklassen, wie z.B. gegen Colistin, Makrolide und Carbapeneme, deutet sich an und muss genau überwacht werden.
Der vielfach geforderte sorgfältige Umgang mit Antibiotika muss in der Praxis konsequent gelebt werden. Hierbei ist der Einsatz von CIA auf das unbedingt notwendige Maß zu begrenzen. Gleichzeitig darf dies aber nicht zulasten anderer Wirkstoffe erfolgen, d.h., es ist insgesamt der Einsatz von Antibiotika weiter zu reduzieren.
Referenzen
AGES (2016b). Bericht über den Vertrieb von Antibiotika in der Veterinärmedizin in Österreich 2011–2015. K. Fuchs und R. Fuchs (Autoren). www.ages.at/download/0/0/946d415e253db42c1be6fa4a0bce7ae65d898560/fileadmin/AGES2015/Themen/Arzneimittel_Medizinprodukte_Dateien/AB_Mengen_AUT_Bericht_2015_barrierefrei.pdf
AURES (2015). Resistenzbericht Österreich. AURES 2014, Antibiotikaresistenz und Verbrauch antimikrobieller Substanzen in Österreich. www.bmg.gv.at/home/Schwerpunkte/Krankheiten/Antibiotikaresistenz/
AURES (2016a). Resistenzbericht Österreich. AURES 2015, Antibiotikaresistenz und Verbrauch antimikrobieller Substanzen in Österreich. www.bmg.gv.at/home/Schwerpunkte/Krankheiten/Antibiotikaresistenz/
EFSA and ECDC (2015). European Food Safety Authority and European Centre for Disease Prevention and Control. The European Union Summary Report on Trends and Sources of Zoonoses, Zoonotic Agents and Food-borne Outbreaks in 2014. EFSA Journal 2015;13(12):4329.
EMA (2014). European Medicines Agency, Veterinary Medicines Division/CVMP/CHMP. Answers to the requests for scientific advice on the impact on public health and animal health of the use of antibiotics in animals. (EMA/381884/2014).
EMA (2016a). European Medicines Agency, European Surveillance of Veterinary Antimicrobial Consumption, 2016. Sales of veterinary antimicrobial agents in 29 European countries in 2014. (EMA/61769/2016).
EMA (2016b). European Medicines Agency Committee for Medicinal Products for Veterinary use (CVMP), Committee for Medicinal Products for Human Use (CHMP). Updated advice on the use of colistin products in animals within the European Union: development of resistance and possible impact on human and animal health. (EMA/CVMP/CHMP/231573/2016).
FAO/WHO/OIE (2007). Joint FAO/WHO/OIE Expert Meeting on Critically Important Antimicrobials. Report of the FAO/WHO/OIE Expert Meeting. Rome, 26–30 November 2007. www.fao.org/3/a-i0204e.pdf.
Fetsch A, Kraushaar B, Käsbohrer A, Hammerl JA. (2016). Turkey Meat as Source of CC9/CC398 Methicillin-Resistant Staphylococcus aureus in Humans? Clin Infect Dis. 2016 Oct 6. pii: ciw687.
Fischer J, San José M, Roschanski N, Schmoger S, Baumann B, Irrgang A, Friese A, Roesler U, Helmuth R, Guerra B. (2016). Spread and persistence of VIM-1 Carbapenemase-producing Enterobacteriaceae in three German swine farms in 2011 and 2012. Vet Microbiol. 2016 May 7. pii: S0378-1135(16)30116-X. doi: 10.1016/j.vetmic.2016.04.026.
Irrgang A, Roschanski N, Tenhagen BA, Grobbel M, Skladnikiewicz-Ziemer T, Thomas K, Roesler U, Käsbohrer A. (2016). Prevalence of mcr-1 in E. coli from Livestock and Food in Germany, 2010–2015. PLoS One. 2016 Jul 25;11(7):e0159863. doi: 10.1371/journal.pone.0159863.
KOM (2013). Durchführungsbeschluss der Kommission vom 12. November 2013 zur Überwachung und Meldung von Antibiotikaresistenzen bei zoonotischen und kommensalen Bakterien (2013/652/EU). Amtsblatt der Europäischen Union, L 303/26. eur-lex.europa.eu/legal-content/DE/TXT/PDF/
OIE (2015). OIE LIST OF ANTIMICROBIAL AGENTS OF VETERINARY IMPORTANCE. www.oie.int/fileadmin/Home/eng/Our_scientific_expertise/docs/pdf/Eng_OIE_List_antimicrobials_May2015.pdf
WHO (2012). Critically important antimicrobials for human medicine –3rd rev. apps.who.int/iris/bitstream/10665/77376/1/9789241504485_eng.pdf
