Jester blieb nach der Operation zwei Tage stationär zur Überwachung, Infusionstherapie (Ringerlactat DTI 4 ml/kg/h), antiemetischer Therapie mit Maropitant (1 mg/kg SID) und Schmerzmanagement (Butorphanol 0,2 mg/kg alle 6 h i.v.). Danach wurde der Patient in häusliche Pflege entlassen mit Antibiose (Metronidazol 10 mg/ kg SID), Schonkost (püriertes Hühnchen und Reis in kleinen Portionen), Magenschutztherapie (Sucralfat 30 mg/kg BID) und Halskrause.
Feline Gastrointestinale Eosinophile Sklerosierende Fibroplasie (FGESF
bei einer 1,5 Jahre alten Katze
Dr.med.vet. Isabelle Wandling
Mag.med.vet. Elisabeth Kasper
Ausgabe 07-08/2017

Der vorliegende Fallbericht veranschaulicht die diagnostischen und therapeutischen Schritte bei der Aufarbeitung einer intraabdominalen Umfangsvermehrung einer jungen Katze und unterstreicht die Wichtigkeit der histologischen Untersuchung.
Patient
„Jester“, Europäisch Kurzhaar, männlich, kastriert,
1,5 Jahre alt, 3,7 kg.
Anamnese
Der Patient wurde mit folgendem Vorbericht vom Haustierarzt an die Tierklinik Aspern überwiesen: Jester zeigte seit zwei Monaten rezidivierendes Erbrechen und Gewichtsverlust. Trotz antiemetischer Therapie mit Metoclopramid und Ulcusprophylaxe (Ranitidin) stellte sich keine Besserung der Symptome ein. Bei der Kontrolluntersuchung fiel dem vorbehandelnden Kollegen eine palpable Masse im cranialen Abdomen auf, weswegen er die Katze zur weiteren Diagnostik an die Klinik überwies.
Klinische Untersuchung
Bei der Erstvorstellung war die Hautelastizität geringgradig vermindert. Die IKT betrug 38,4 °C. Die BDS war ggr. erhöht und das Abdomen cranial nicht durchtastbar. Eine ca. kinderfaustgroße harte Umfangsvermehrung im Bereich des Magens konnte ertastet werden.
Röntgen
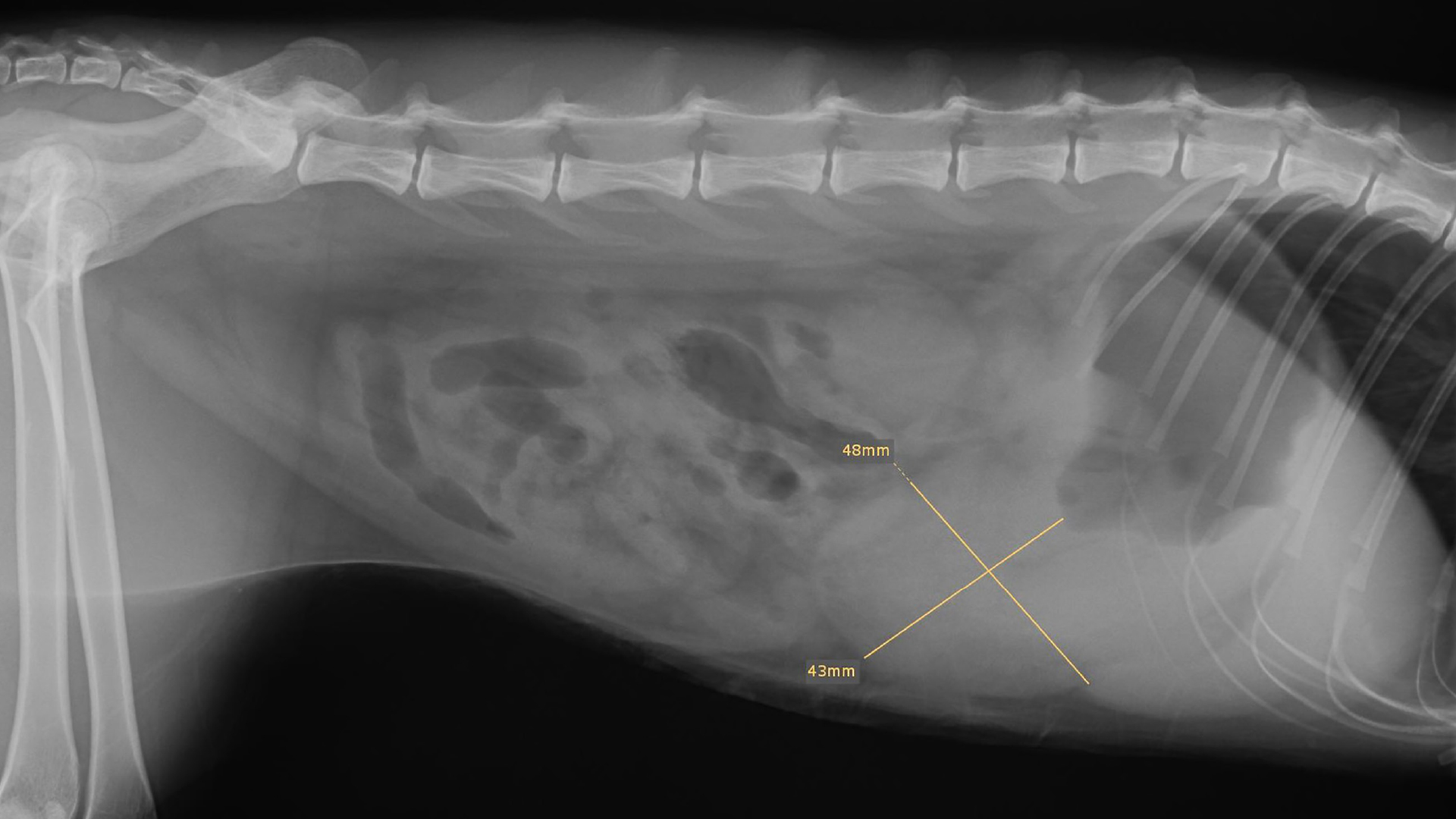
Im Bereich des Magens konnte eine ca. 4 mal 5 cm große weichteildichte Verschattung dargestellt werden (siehe Abb. 1).
Ultraschall
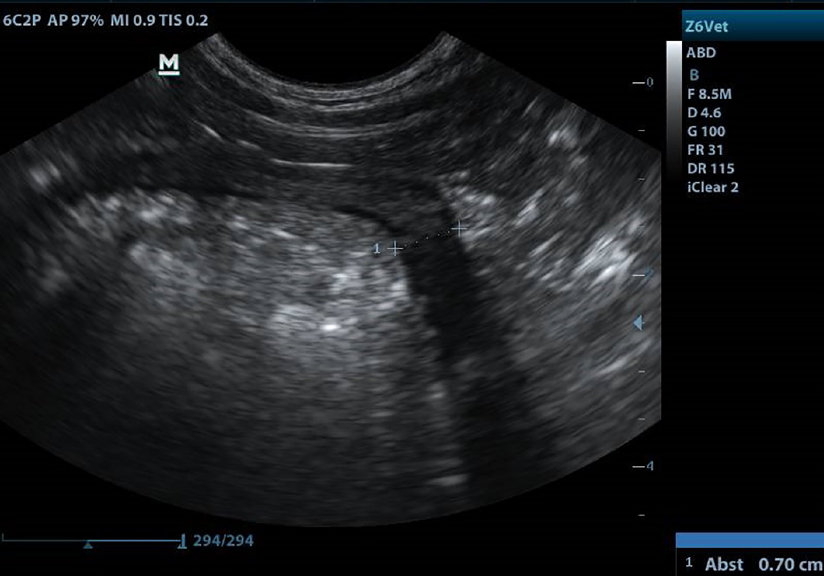
Der Magen war aufgrund starker Gasbildung nicht zur Gänze einsehbar. Im Bereich des corpus ventriculi stellte sich die Wand allerdings deutlich echoarm verbreitert bis 4 cm mit teils hyperechogenen Arealen ohne distale Schallauslöschung dar. Die physiologische Wandschichtung war verloren gegangen. Die regionalen Lymphknoten waren echoarm vergrößert.
Probelaparotomie und Biopsie
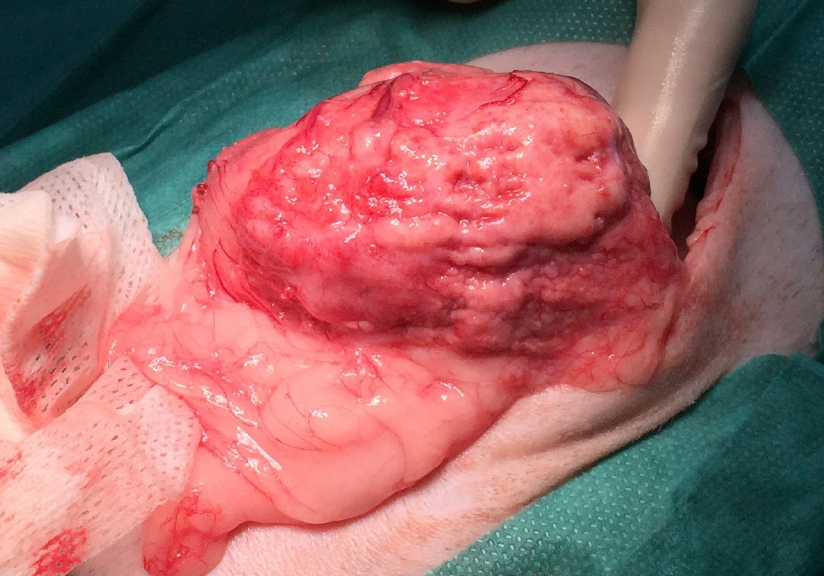
Aufgrund des Tastbefunds, des ungewöhnlichen Ultraschallbefunds und der radiologischen Veränderungen des Magens entschlossen wir uns zu einer explorativen Laparotomie. Die Prämedikation erfolgte mit Acepromazin 0,05 mg/kg, Ketaminhydrochlorid 2 mg/kg und Butorphanol 0,1 mg/kg intravenös, die Einleitung langsam mit Propofol 5 mg/kg bis zum Wirkungseintritt und die Erhaltung mit Isofluran nach Intubation. Die Eröffnung des Abdomens wurde routinemäßig in der Linea alba vorgenommen. Bei der Exploration der Bauchhöhle trat eine rötliche längliche Masse mit zerklüfteter Oberfläche in Erscheinung, die vom Magen ausging (siehe Abb. 2).
Die Magenwand des corpus ventriculi war an der curvatura major wie an der curvatura minor und Teilbereichen des Fundus derb bis knorpelig hart verändert und stellenweise bis zu 4 cm dick. Cardia und Pylorus waren von den Veränderungen nicht betroffen. Eine Neoplasie schien die plausibelste Erklärung zu sein. Eine Komplettresektion der Raumforderung schien uns beinahe unmöglich zu sein bzw. würde diese mit einer drastischen Einschränkung der Lebensqualität einhergehen. Aufgrund des jungen Alters des Katers und den massiven Veränderungen, die den Magen erfasst hatten, entschlossen wir uns dazu, Allschichtbiopsien an drei unterschiedlichen Lokalisationen zu entnehmen. Dazu wurde jeweils eine Inzision bis in das Lumen durchgeführt und eine spindelförmige, ca. 1,5cm mal 0,5cm große Probe exzidiert.
Anschließend wurde der Magen mit monofilem Nahtmaterial der Stärke 3/0 in zwei Schichten (Einzelknopfnaht und Lembert) verschlossen. Die restlichen Organe inklusive des Darmkonvoluts waren makroskopisch ohne pathologischen Befund. Die Bauchdecke und Subkutis wurden mit monofilem Nahtmaterial der Stärke 3/0 in fortlaufender Naht verschlossen. Die Hautnaht erfolgte intrakutan ebenfalls mit monofilem Nahtmaterial der Stärke 4/0.
Histologie
Die Proben wurden an Dr. Klemens Alton (Labor in Histo) geschickt und histologisch untersucht. Die Probenteile zeigten im Bereich der Muscularis und der Submucosa eine diffuse Sklerosierung des Gewebes mit multifokalen entzündlichen Infiltraten, die vor allem von Eosinophilen gebildet werden. Lymphozyten und Plasmazellen kommen im geringen Maße vor; die Schleimhaut selbst ist nicht entzündlich verändert und auch das Oberflächenepithel erscheint intakt.
Diagnose:
Feline gastrointestinale eosinophile sklerosierende Gastritis/Fibroplasie (FGESF).
Therapie und weiterer Verlauf
Acht Tage post operationem wurde die Antibiose beendet. Die Operationswunde heilte komplikationslos ab. Aufgrund des nun vorliegenden pathohistologischen Befundes wurde 14 Tage nach dem Eingriff eine orale Therapie mit Prednisolon 1,3 mg/kg BID eingeleitet. Zur Ulcusprophylaxe wurde Famotidin 1 mg/kg SID eingesetzt. Zusätzlich sollte Jester eine strenge Diät einhalten, bestehend aus Vet Concept® Cat Sana Pferd oder Büffel, Royal Canine® Hypoallergenic bzw. Intestinal.
Bereits wenige Tage nach der Operation sistierte das Erbrechen. Die darauffolgenden Kontrolluntersuchungen wurden beim Haustierarzt durchgeführt. Zwei Monate nach Therapiebeginn wurde der Patient wieder in die Tierklinik Aspern bestellt. Jester war laut Besitzerin bei gutem Appetit und legte wieder kontinuierlich an Gewicht zu. Bei der klinischen Untersuchung konnte keine Masse im cranialen Abdomen mehr palpiert werden. Sonographisch stellte sich die Magenwand des Fundus und Corpus allerdings immer noch echoarm verbreitert bis knapp 1 cm dar (siehe Abb. 3). Aufgrund der erhobenen Befunde und der deutlichen Verbesserung des Allgemeinbefindens wurde eine Dosisreduktion auf 5 mg Prednisolon SID vorgenommen. Jester bekam weiterhin Famotidin zur Ulcusprophylaxe und ausschließlich Diätnahrung.
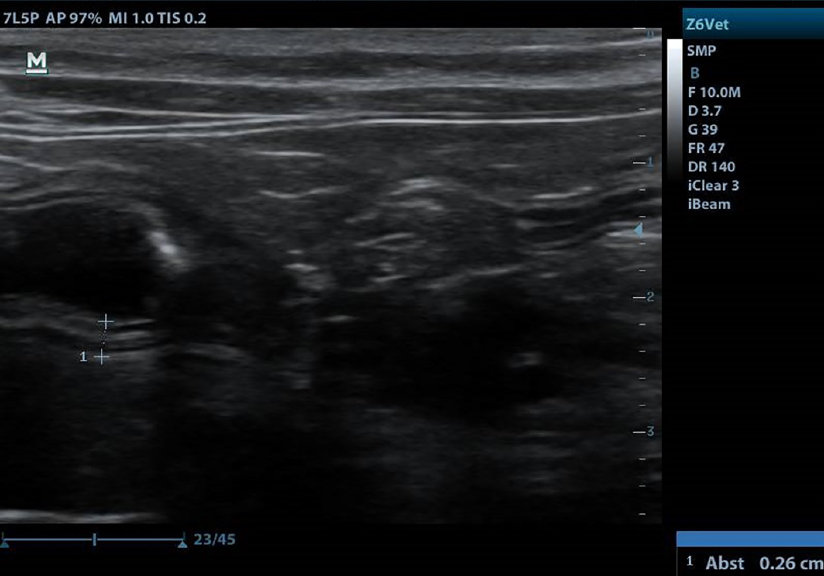
Sechs Monate nach Therapiebeginn hatten sich alle Veränderungen zurückgebildet, die Wandschichtung war wieder erhalten und die Wanddicke unter 0,5 cm (siehe Abb. 4). Daher wurde die Cortisondosis in vier- bis sechswöchigen Intervallen weiter schrittweise reduziert (Prednisolon 2,5 mg SID und danach 2,5 mg alle 2 Tage).
Der Patient ist knapp ein Jahr nach Diagnosestellung immer noch beschwerdefrei und sonographisch unauffällig. Die Therapie bestehend aus Diätfutter und Prednisolon (2,5 mg alle 2 Tage) wird weitergeführt. Jester kommt weiterhin alle sechs Monate zur Ultraschallkontrolle.
Diskussion
Die feline gastrointestinale eosinophile sklerosierende Fibroplasie (FGESF) ist eine relativ seltene und unbekannte Erkrankung. Auch uns hat die imposante Zubildung der Magenwand vor ein großes Rätsel gestellt. Das erschreckende Erscheinungsbild kann leicht als bösartiger Tumor missinterpretiert werden.
Die feline gastrointestinale eosinophile sklerosierende Fibroplasie (FGESF) stellt eine Art der eosinophilen Entzündung dar und definiert sich durch die Anwesenheit eosinophiler Massen, die sich auf den Gastrointestinaltrakt und die regionalen Lymphknoten beschränken. Die Ursache dieser Erkrankung ist unbekannt. Obwohl direkte Beweise fehlen, wurde die Hypothese formuliert, dass manche Katzen eine genetische Prädisposition aufweisen, eine eosinophile Entzündung als Antwort auf Antigene wie Bakterien oder Parasiten zu entwickeln (Linton et al., 2015). Bakterien konnten bei einem wesentlichen Anteil der Katzen aus den Läsionen isoliert werden, aber nicht bei allen. Es bleibt daher unklar, ob Bakterien eine primäre oder sekundäre Rolle bei der Entstehung dieses Krankheitsbildes spielen (Linton et al., 2015). Weiters wird eine immunologische Dysregulation angenommen, die durch Futtermittelallergien oder -intoleranzen, Dysbakterie oder andere Faktoren (Endoparasiten, aufgenommene Haare oder Pflanzenteile) getriggert wird (Linton et al., 2015).
Histomorphologisch wird die FGESF durch ihr charakteristisches trabekuläres Muster aus dichtem Kollagen, das Osteoid ähnelt, geprägt. Dies kann manchmal zu der fälschlichen Diagnose Osteosarkom führen. Auch die Verwechslung mit einem Mastzelltumor ist aufgrund des oft hohen Anteils an Mastzellen möglich (Suzuki et al., 2013).
Vor allem Katzen mittleren Alters (median 7 Jahre), Ragdolls sowie männliche Tiere scheinen von dieser relativ unbekannten Krankheit vermehrt betroffen zu sein (Linton et al., 2015) und häufig werden erkrankte Tiere noch während der explorativen Laparotomie aufgrund des malignen Erscheinungsbildes euthanasiert. Deshalb liegt es uns am Herzen, mehr Bewusstsein für diese Erkrankung zu schaffen.
Viele Therapieformen (Operation, Antibiose, Kortiko-steroide, Analgetika etc.) wurden bislang in der Literatur diskutiert, aber welches Regime tatsächlich am besten funktioniert, ist unklar. Fest steht, dass eine frühzeitige Diagnose und Therapie für ein erfolgreiches Ergebnis ausschlaggebend sind. Weiters scheint Kortison die Überlebenszeit positiv zu beeinflussen (Linton et al., 2015) und betroffene Tiere können mit entsprechender Behandlung mehrere Jahre überleben.
Auch für uns war Jester der erste Patient, der an feliner gastrointestinaler eosinophiler sklerosierender Fibroplasie (FGESF) erkrankt war. Deshalb stellten wir uns die Frage, ob der Körper in der Lage sein würde, das massiv zugebildete Gewebe wieder abzubauen. Mit einer kompletten Remission der Veränderungen hätten wir niemals gerechnet. Ob dieser Therapieerfolg dauerhaft ist, werden die nächsten Jahre zeigen.
Dieser Fallbericht soll eine relativ unbekannte Erkrankung vorstellen, die Wichtigkeit einer histologischen Untersuchung unterstreichen und vor einer vorschnellen Euthanasie warnen. Vielleicht denken Sie ja beim nächsten ähnlich gelagerten Fall an Jester.
Literatur
Linton, M., Nimmo, J. S., Norris, J. M., Churcher, R., Haynes, S., Zoltowska, A., … & Malik, R. (2015). Feline gastrointestinal eosinophilic sclerosing fibroplasia: 13 cases and review of an emerging clinical entity. Journal of feline medicine and surgery, 17(5), 392–404.
Suzuki, M., Onchi, M., & Ozaki, M. (2013). A case of feline gastrointestinal eosinophilic sclerosing fibroplasia. Journal of toxicologic pathology, 26(1), 51–53.
Craig, L. E., Hardam, E. E., Hertzke, D. M., Flatland, B.,Rohrbach, B. W., & Moore, R. R. (2009). Feline gastrointestinal eosinophilic sclerosing fibroplasia. Veterinary Pathology Online, 46(1), 63–70.
Weissman, Andrea, et al.(2013). „Ultrasonographic and clinicopathological features of feline gastrointestinal eosinophilic sclerosing fibroplasia in four cats.“ Journal of feline medicine and surgery 15.2 (2013): 148–154.
