Ein portosystemischer Shunt bei einem Europäisch-Kurzhaar-Kater
Fallbericht
Mag.med.vet. Alan Kronberg
Ausgabe 04/2024

Patient
Petzi, ein männlicher, kastrierter Europäisch-Kurzhaar-Kater, wurde im August 2023 in unserer Tierklinik vorgestellt. Er war zu diesem Zeitpunkt zwei Jahre und sechs Monate alt und wog 3,75 kg. Es bestand kein Auslandsvorbericht, er war regelmäßig geimpft und entwurmt.
Anamnese
Bei der Erstvorstellung zeigte er laut Besitzerin eine unspezifische Symptomatik mit vorübergehender Apathie, Tachypnoe, Ataxie, Ptyalismus, erschwertem Kotabsatz und vermehrtem Putzverhalten in der Analregion. Bis auf die kurze Vorbehandlung einer Alopezie (Prednisolon) beim Haustierarzt mehrere Monate zuvor bekam er keine Medikamente. Die Erstbehandlung erfolgte auf Besitzerwunsch rein symptomatisch mit Maropitant 1 mg/kg s.c. und einem Einlauf, woraufhin Petzi für zwei Monate keine weitere Symptomatik zeigte. Im Oktober 2023 wurde er erneut vorgestellt, diesmal berichtete die Besitzerin allerdings über eine Verstärkung der Symptomatik nach der Futteraufnahme. Er war danach regelmäßig desorientiert, matt und zeigte mehrere Symptome einer akuten Hepatoenzephalopathie, wie generalisierte Ataxie, fokale Zuckungen am Kopf und Körper sowie Ptyalismus. Eine geringgradige Gewichtsabnahme im Vergleich zum letzten Besuch war auffällig.
Klinische Untersuchung
Die allgemeine klinische Untersuchung zeigte bis auf ein verändertes Gangbild und eine veränderte Irisfarbe (kupferfarben) sowie eine erhöhte Atemfrequenz (50/Minute) keine vom Normbereich abweichenden Befunde. Bei der neurologischen Untersuchung wurden Ataxie und unkoordinierte Bewegungen festgestellt, die Spinalreflexe sowie die Kopfnerven waren unauffällig, er war geh- und stehfähig.
Diagnostik
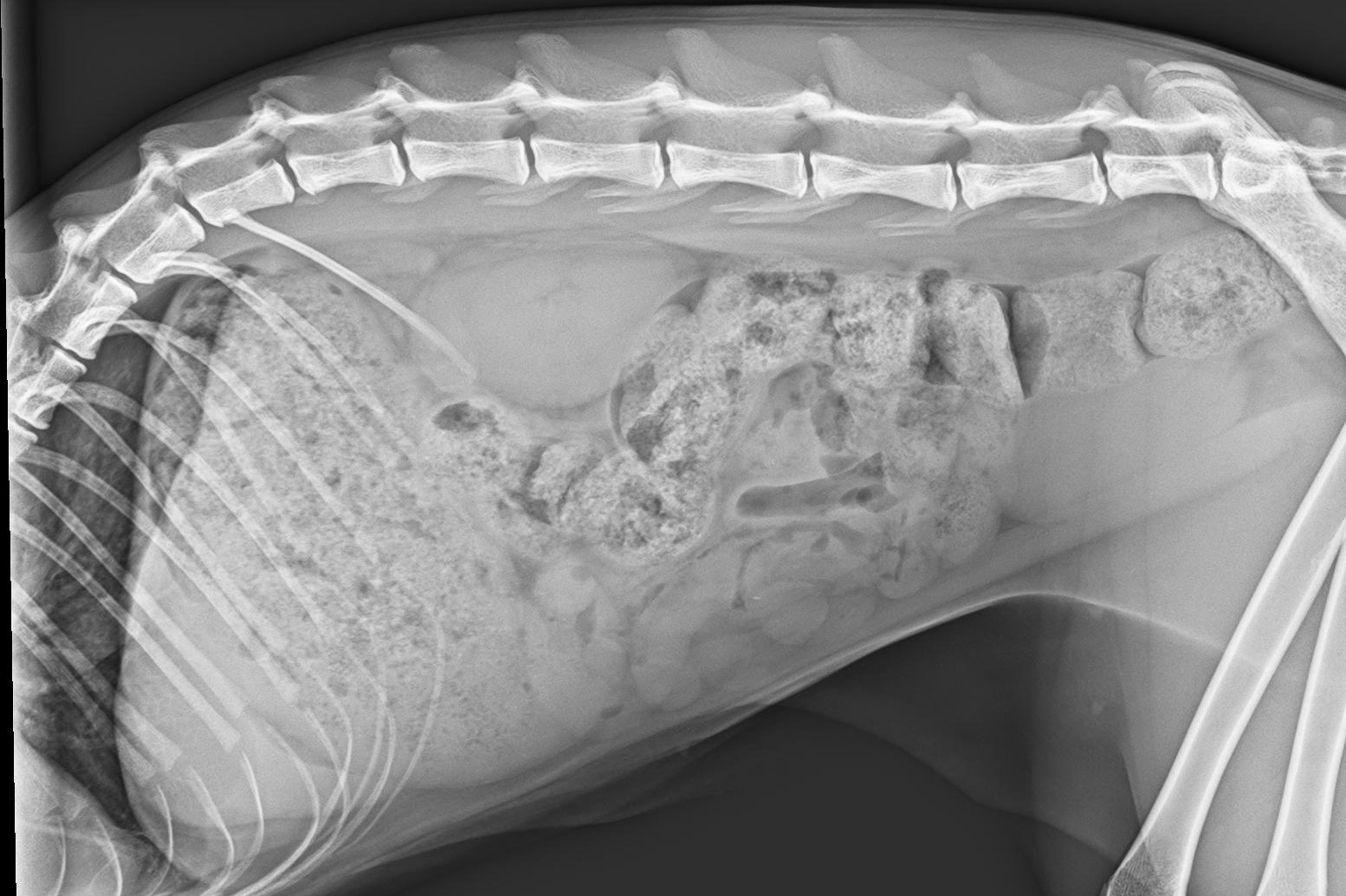
Röntgenaufnahmen des Thorax ergaben keinen abnormen Befund. Die Aufnahmen des Abdomen zeigten einen sehr stark gefüllten Gastrointestinaltrakt und eine relativ kleine Leber (Abb. 1).
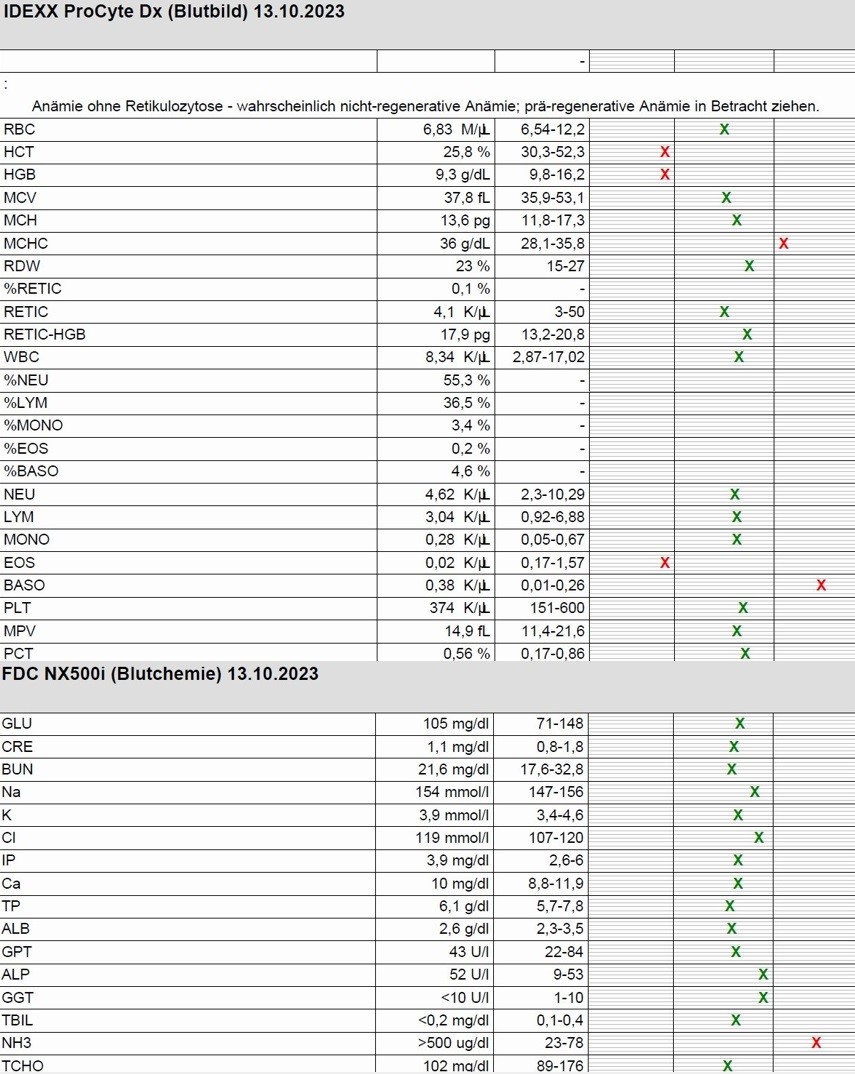
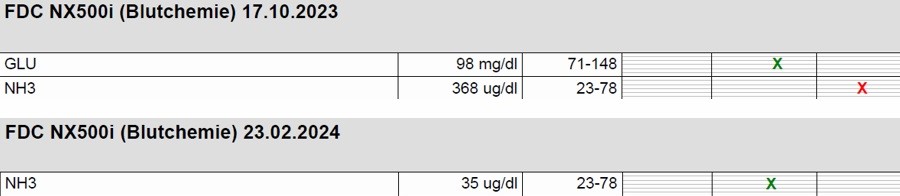
Bei der hämatologischen Untersuchung waren ein geringgradig erniedrigter Hämatokrit (25,8 % [30,3-52,3]) und Hämoglobin (9,3 g/dl [9,8-16,2]), eine geringgradig erhöhte MCHC (36 g/dl [28,1-35,8]), eine Eosinopenie (0,01K/μL [0,17-1,57]) sowie eine Basophilie (0,38K/μL [0,01-0,26]) auffällig, die restlichen Parameter waren im Referenzbereich. Die Blutchemie zeigte einen hochgradig erhöhten Ammoniakgehalt (>500 μg/dl [23-78]). (Abb. 2)
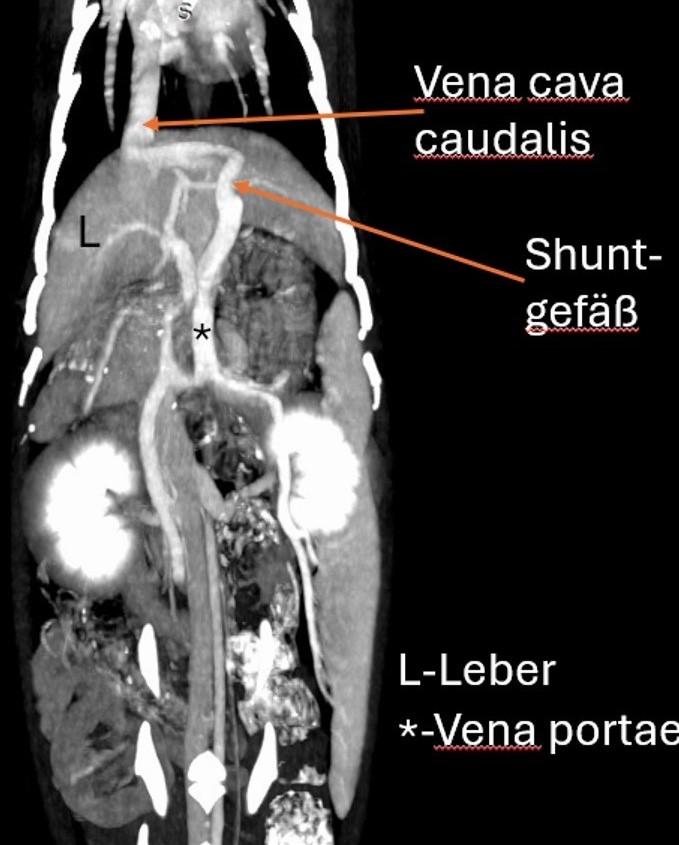
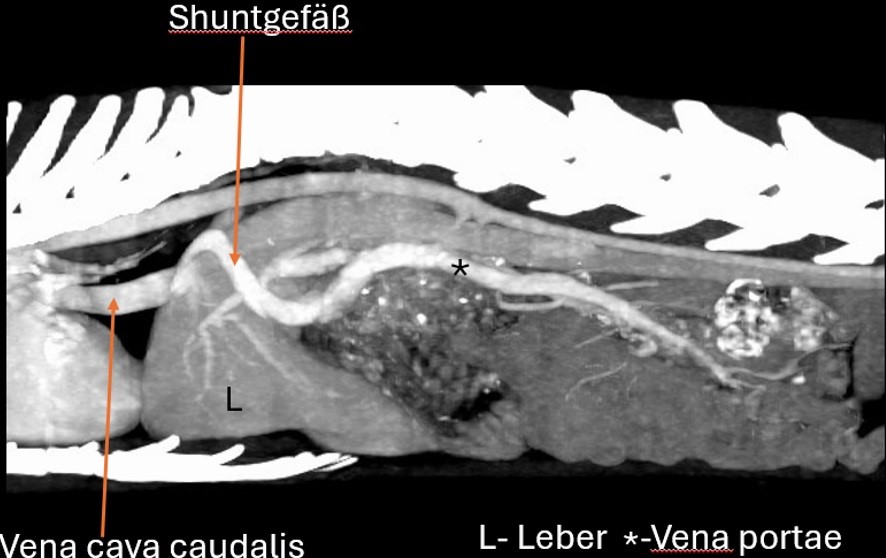
Eine vollständige Ultraschalluntersuchung war aufgrund mangelnder Kooperation des Patienten nicht möglich, daher wurde entschieden, den Kater initial zu stabilisieren und später eine Abdomen-CT in Narkose durchzuführen. Petzi wurde stationär aufgenommen und symptomatisch mit Dauertropfinfusion und Maropitant 1 mg/kg i.v. behandelt. Am nächsten Tag wurde in Narkose eine CT-Angiographie (jodhaltiges Kontrastmittel 2 ml/kg) durchgeführt. Die Narkoseeinleitung erfolgte mit Midazolam 1 mg/kg, Ketamin 20 mg/kg und anschließend Propofol 2-5 mg/kg nach Wirkung; die Narkose wurde mit Sevofluran 2,5 % erhalten. Ein extrahepatischer portosystemischer Shunt (PSS) in Form eines linken Gastrophrenica-Shunts konnte dargestellt werden (Abb. 3, 4). Aufgrund des Schweregrades der Symptomatik wurde entschieden, den extrahepatischen PSS auf dem chirurgischen Weg noch in derselben Woche zu versorgen.
Therapie
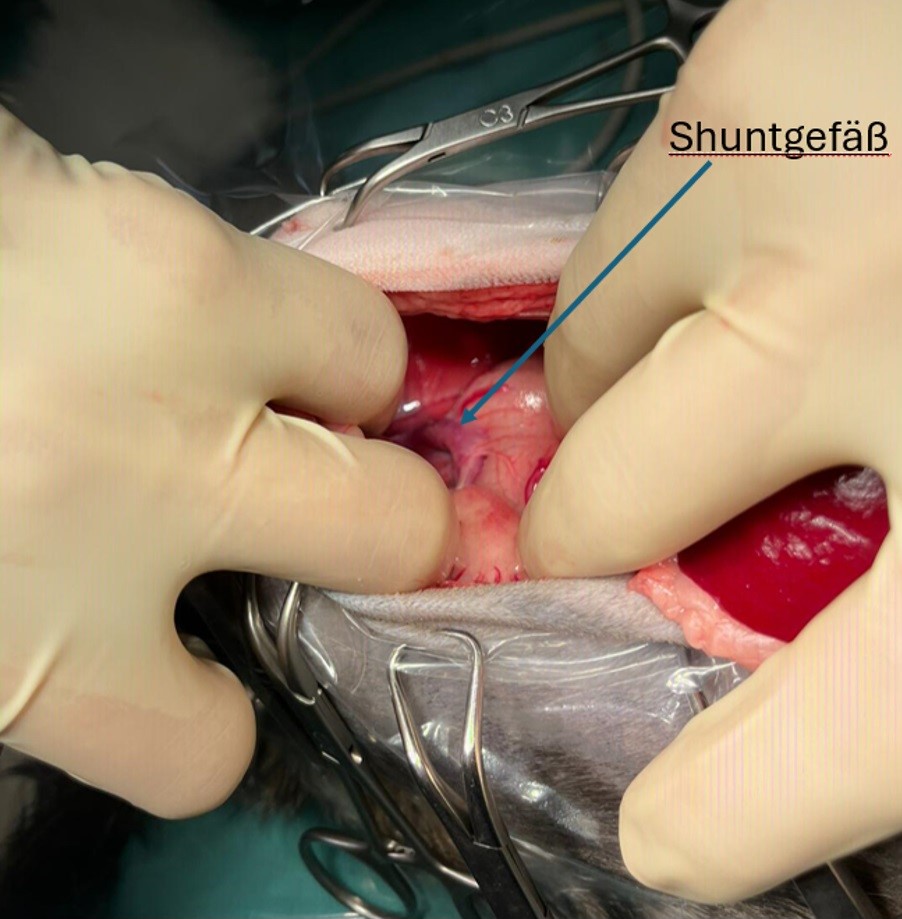
Die Narkose erfolgte bei der Operation erneut wie oben beschrieben. Nach einem Zugang in der Linea alba wurde das Shuntgefäß identifiziert und nahe der Mündung in die hintere Hohlvene vom umliegenden Gewebe stumpf freipräpariert (Abb. 5). Ein 5-mm-Ameroid-Konstriktor wurde um das Shuntgefäß platziert und verschlossen. Die restlichen Organe wurden optisch kontrolliert, der Bauchwandverschluss erfolgte routinemäßig in drei Schichten.
Petzi blieb noch eine Nacht stationär und erhielt weiter eine unterstützende Infusionstherapie. Die Analgesie erfolgte mit Meloxicam 0,05 mg/kg i.v. einmal täglich, die Antibiose mit Amoxicillin/Clavulansäure. Lactulose in der Startdosierung von 2 ml p.o. zweimal täglich wurde verschrieben und die Fütterung umgestellt. Eine Ultraschallkontrolle einen Tag nach der Operation zeigte keinen Hinweis auf eine relevante portale Hypertonie (kein Aszites). Der Patient fraß, war bei gutem Allgemeinbefinden und wurde daher nach Hause entlassen.
Verlauf und Kontrolle
Drei Tage später kam er wieder zur Kontrolle, wobei die Besitzerin über noch immer vorhandenen Ganzkörpertremor und Polyphagie, zum Teil auch von fokalen Anfällen berichtete. Aus diesem Grund wurde Levetiracetam mit 17 mg/kg p.o. dreimal täglich verschrieben. Eine Woche nach der Operation wurde erneut eine abdominale Sonographie gemacht, diese war weiterhin unauffällig. Das Ammoniak war im Referenzbereich, die neurologische Symptomatik hatte sich deutlich verbessert, daher wurde die Therapie mit Levetiracetam über zwei weitere Wochen ausgeschlichen. Bei der Kontrolle einen Monat nach der Operation war der Patient bei bestem Allgemeinbefinden, obwohl das Ammoniak minimal erhöht war (Abb. 6). Es konnte sonographisch kein Blutfluss mehr im Shuntgefäß dargestellt werden und die ursprüngliche neurologische Symptomatik war nicht mehr vorhanden. Die Abschlusskontrolle erfolgte vier Monate nach der Operation. Dem Patienten ging es weiterhin sehr gut und der Ammoniakwert war im Referenzbereich (Abb. 6).
Dieser Fall zeigt, dass die Identifikation eines PSS bei der Katze aufgrund von der nicht immer eindeutigen Symptomatik eine Herausforderung darstellen kann, vor allem, weil man diese Erkrankung bei einem zwei Jahre alten Tier nicht mehr unbedingt differentialdiagnostisch berücksichtigt. Die Erkrankung zeigt bei einer Kombination aus adäquater chirurgischer Versorgung und entsprechender medikamentöser Therapie eine gute Prognose.
Diskussion
Der portosystemische Shunt ist bei der Katze eine sehr seltene Erkrankung (Inzidenz ~ 2,5/10.000 Patienten)6, welche diagnostisch eine große Herausforderung darstellen kann. Es handelt sich dabei um eine abnormale Verbindung zwischen dem portalen und systemischen venösen Gefäßsystem in Form eines oder mehrerer zusätzlich ausgebildeter Gefäße. Durch diese Gefäße kann das Blut auf seinem Weg die Leber umgehen. Somit werden viele toxische Substanzen, die im Darm entstehen (u. a. Ammoniak) aus dem Kreislauf nicht ausreichend eliminiert3.
Beim PSS unterscheidet man die häufigeren angeborenen PSSs von den selteneren erworbenen, welche in der Regel Folge einer Hepatopathie und eines erhöhten portalen Gefäßwiderstands sind. Ein angeborener PSS kann entweder außerhalb des Leberparenchyms (extrahepatischer PSS) oder innerhalb von diesem vorliegen (intrahepatischer PSS)3,6. Bei der Katze kommen die extrahepatischen PSSs am häufigsten vor (73–100 %)6. Auch hier unterscheidet man, abhängig von den involvierten Venen, verschiedene Formen, wobei die Gefäßverbindung zwischen der linken gastrischen Vene und der Vena phrenica (linker Gastrophrenica-Shunt) bei der Katze am häufigsten beschrieben ist (49–70 %). Weitere beschriebene Formen sind unter anderem ein linker Gastroazygos-Shunt, ein Splenocavaler Shunt oder ein linker Gastrocavaler Shunt1,8. Es besteht eine Rasseprädisposition für Europäisch-Kurzhaar-Katzen, Perser, Siam, Himalaya und Burma, wobei männliche Tiere möglicherweise häufiger betroffen sind3,6. Katzen mit einem extrahepatischen PSS werden mit unterschiedlicher Symptomatik und meistens in einem jüngeren Alter (ca. ein Monat bis zwei Jahre), selten auch viel später (zum Teil mit über 10 Jahren)3 vorgestellt. Zu den häufigsten Vorstellungsgründen gehören neurologische Symptome wie Anfallsgeschehen, Ataxie, Ptyalismus, Blindheit, Tremor, Lethargie und Verhaltensänderungen. Die Beschwerden treten häufig intermittierend auf, da sie mit dem aktuellen Level der toxischen Substanzen im Blut korrelieren. Ein zeitlicher Zusammenhang mit der Futteraufnahme besteht manchmal. Die Katzen sind häufig kleinwüchsig und können Gewichtsabnahme oder eine kupferfarbene Iris zeigen3. Ebenso können gastrointestinale Beschwerden oder Zeichen einer Harnwegserkrankung Vorstellungsgründe sein.
Die notwendige Diagnostik beinhaltet die Anamnese und klinische Untersuchung, eine vollständige Blut- und Urinuntersuchung inklusive Ammoniak und Gallensäuren sowie bildgebende Verfahren wie Ultraschall und/oder CT-Angiographie. Eine klinische Stabilisierung des Patienten vor der Operation sollte versucht werden, solange es der Schweregrad seiner Symptomatik ermöglicht. Die konservative Therapie umfasst eine Futterumstellung auf eine leicht verdauliche, faserreiche Diät mit einem Proteingehalt von ca. 35 %, einem erhöhten Anteil an verzweigtkettigen Aminosäuren und Arginin sowie die orale Gabe von Lactulose und antiepileptischen Medikamenten3,4. Das Nutzen der früher häufiger eingesetzten Antibiose zur Reduktion der antimikrobiellen Besetzung des Colons wird mittlerweile kritisch diskutiert und sollte in Bezug auf immer häufigere Antibiotikaresistenzen gut überlegt werden7. Verschiedene chirurgische Behandlungsoptionen wurden beschrieben, unter anderem der Einsatz von Ameroid-Konstriktoren, Zellophan-Bands, (fraktionierter) Ligatur sowie intravaskuläre Techniken1-4. Die Behandlung eines extrahepatischen PSS mit einem Ameroid-Konstriktor ist laut einer aktuellen Studie mit einer guten bis sehr guten postoperativen Langzeitprognose (Verbesserung der Symptomatik in 88 % der Fälle) beschrieben2. Ähnliche Erfolgsraten wurden auch nach der Behandlung mit Zellophan-Band (56-100 %) und Ligatur (83 %) beschrieben9. Zu den häufigsten Komplikationen postoperativ gehört die Entwicklung einer ZNS-Symptomatik, selbst wenn diese präoperativ noch nicht bestanden hat (Anfälle, Speicheln, Tremor, Drangwanderung etc.). Katzen sind hier im Vergleich zum Hund sehr häufig betroffen (bis zu 60 %) und die Mortalitätsrate nach der Entwicklung solcher neurologischen Symptome liegt zwischen vier und 22 %10. Die Entwicklung der postoperativen neurologischen Symptomatik ist ätiologisch einer präoperativen Hepatoenzephalopathie nicht gleichzusetzen und wurde noch nicht vollständig geklärt, eine erniedrigte postoperative Blutplasmaosmolalität stellt jedoch einen Risikofaktor dar11. Weitere Komplikationen sind unter anderem eine Hypoglykämie, portale Hypertension mit hypovolämischem Schock/Aszites und das Wiederauftreten der ursprünglichen Symptomatik.
Literaturliste:
- Case JB, Solari FP, Vilaplana Grosso F. Percutaneous transvenous coil embolization of an extrahepatic portosystemic shunt in a cat. JFMS Open Rep. 2022 Oct 10;8(2):20551169221126381. doi: 10.1177/20551169221126381. PMID: 36249675; PMCID: PMC9554116.
- Janas KEA, Tobias KM, Aisa J. Clinical outcomes for 20 cats with congenital extrahepatic portosystemic shunts treated with ameroid constrictor ring attenuation (2002-2020). Vet Surg. 2023 Dec 28. doi: 10.1111/vsu.14066. Epub ahead of print. PMID: 38153121.
- Johnston SA Tobias KM. Veterinary Surgery: Small Animal. Second ed. St. Louis Missouri: Elsevier; 2018.
- Konstantinidis AO, Adamama-Moraitou KK, Patsikas MN, Papazoglou LG. Congenital Portosystemic Shunts in Dogs and Cats: Treatment, Complications and Prognosis. Vet Sci. 2023 May 12;10(5):346. doi: 10.3390/vetsci10050346. PMID: 37235429; PMCID: PMC10223741.
- Mullins RA, Serrano Creheut T. Postattenuation neurologic signs after surgical correction of congenital portosystemic shunts in cats: A narrative review. Vet Surg. 2023 Apr;52(3):349-360. doi: 10.1111/vsu.13934. Epub 2023 Jan 11. PMID: 36630563.
- Tivers M, Lipscomb V. Congenital portosystemic shunts in cats: investigation, diagnosis and stabilisation. J Feline Med Surg. 2011 Mar;13(3):173-84. doi: 10.1016/j.jfms.2011.01.010. PMID: 21338942.
- Royal Veterinary College 2024, Clinical Connection Articles, Zugang am 12.01.2024, <https://www.rvc.ac.uk/clinical-connections/clinical-forum-managing-patients-with-portosystemic-shunts>.
- White RN, Shales C, Parry AT. New perspectives on the development of extrahepatic portosystemic shunts. J Small Anim Pract. 2017 Dec;58(12):669-677. doi: 10.1111/jsap.12728. Epub 2017 Sep 5. PMID: 28872684.
- Cabassu J, Seim HB 3rd, MacPhail CM, Monnet E. Outcomes of cats undergoing surgical attenuation of congenital extrahepatic portosystemic shunts through cellophane banding: 9 cases (2000-2007). J Am Vet Med Assoc. 2011 Jan 1;238(1):89-93. doi: 10.2460/javma.238.1.89. PMID: 21194327.
- Strickland R, Tivers MS, Fowkes RC, Lipscomb VJ. Incidence and risk factors for neurological signs after attenuation of a single congenital portosystemic shunt in 50 cats. Vet Surg. 2021 Feb;50(2):303-311. doi: 10.1111/vsu.13489. Epub 2020 Jul 21. PMID: 32691934.
- Strickland R, Tivers MS, Fowkes RC, Lipscomb VJ. Incidence and risk factors for neurological signs after attenuation of a single congenital portosystemic shunt in 50 cats. Vet Surg. 2021 Feb;50(2):303-311. doi: 10.1111/vsu.13489. Epub 2020 Jul 21. PMID: 32691934.

