Update: Dilatative Kardiomyopathie und Dobermann-Kardiomyopathie
Diagnostische und therapeutische Methoden in der Praxis
Mag.med.vet. Doris Bittenecker
Ausgabe 02/2024
Dobermänner sind häufige Patienten beim Kardiologen. Da jedoch durch laufende Studien ständig neue Erkenntnisse gewonnen werden, möchte ich ein Update anhand des folgenden Fallberichts geben. Dobermann-Rüde Bubi, geboren im Oktober 2015, wurde Ende Juni 2023 vorgestellt, nachdem er bereits dreimal synkopiert war. Der Bewusstseinsverlust erfolgte immer beim Spazierengehen bzw. kurz danach, in Ruhe wurde er nie beobachtet. Laut Besitzerin waren ansonsten keine Auffälligkeiten zu bemerken, die Leistung war unverändert. Der Halterin war bekannt, dass ein Dobermann ein hohes Risiko trägt, eine Herzerkrankung zu entwickeln. Da aber mehrmalige kardiologische Untersuchungen zwischen dem dritten und fünften Lebensjahr unauffällig waren, vereinbarte sie keine weiteren empfohlenen Vorsorgetermine.
Die klinische Untersuchung war bis auf vereinzelte Pulsdefizite und einen phasenweise unregelmäßigen Herzschlag unauffällig. Zur vollständigen kardiologischen Abklärung wurden eine Echokardiographie in rechter und linker Seitenlage (Abb. 1), ein Kurzzeit-EKG während des Ultraschalls und ein 24-Stunden-Holter-EKG durchgeführt.
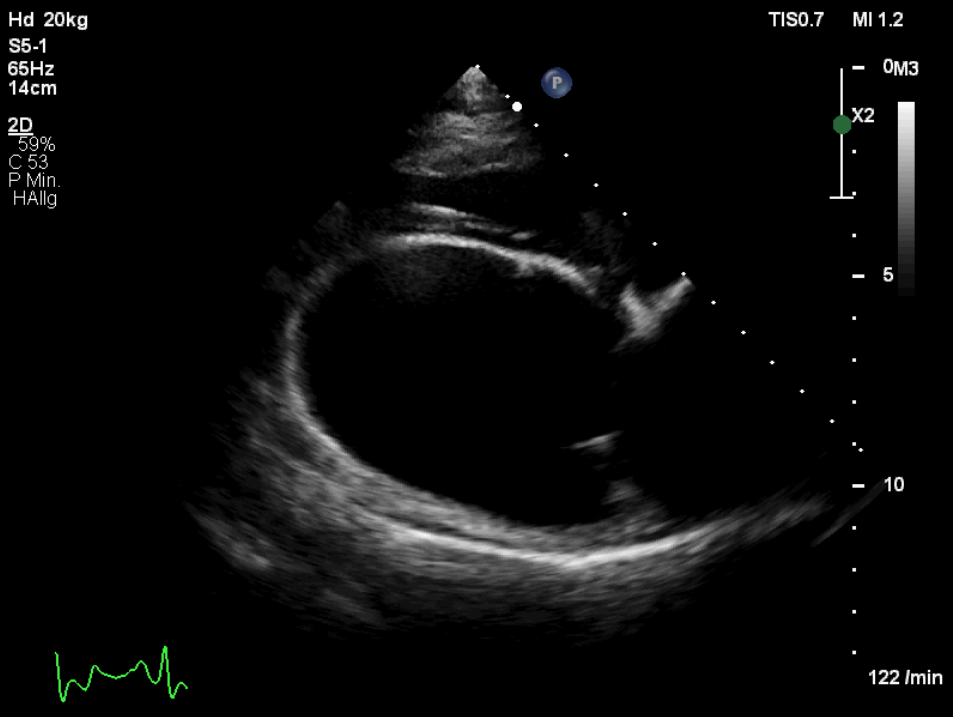
Für die echokardiographische Untersuchung ist i. d. R. keine Sedierung notwendig. An einer kleinen Stelle an der Brustwand werden die Haare geschoren, was aber je nach Haardichte und -beschaffenheit nicht immer notwendig ist. Bei Bubi zeigte sich im Herzultraschall das typische Bild der Dobermann-Kardiomyopathie: Eine Volumenüberladung des linken Ventrikels und des linken Atriums war auffällig, genauso wie eine schlechte systolische Funktion (Abb. 2 und 3). Diese Volumenüberladung führte bereits zu einer geringgradigen sekundären Mitralklappeninsuffizienz.
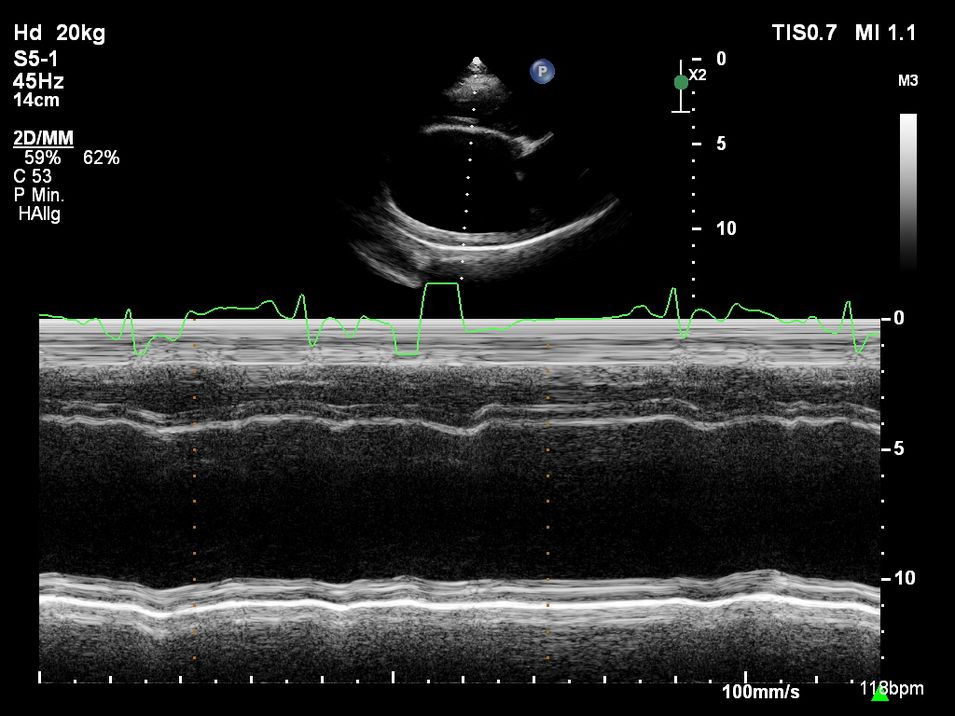
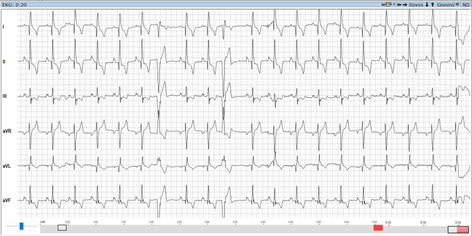
Im Kurzzeit-EKG zeigten sich schon während der Untersuchung ventrikuläre Rhythmusstörungen (Abb. 4). Trotzdem wurde dem Dobermann-Rüden noch ein Langzeit-EKG aufgebaut (Abb. 5 und 6), um das Ausmaß der Rhythmusstörungen und deren Malignität genauer bewerten zu können. Dies ist besonders wichtig für die Therapieentscheidung, da unterschiedliche Medikamente zur Auswahl stehen.
Nach dem Besuch wurde zur Verbesserung der systolischen Funktion Pimobendan, ein Inodilatator, und zur Therapie der Arrhythmien Sotalol verschrieben. Sotalol wird, abhängig von mehreren Faktoren, über einige Zeit eingeschlichen.
Die erste Kontrolle mittels Langzeit-EKG ist etwa vier Wochen nach Erreichen der Sotalol-Enddosis empfohlen, um abschätzen zu können, ob die Therapie ausreicht oder ob sie noch angepasst werden muss. Im Holter-EKG wird einerseits die Anzahl der ventrikulären Extrasystolen (VES) beurteilt, andererseits deren Malignität. Dies ist wichtig, um die Gefährlichkeit der VES und das Risiko für einen Sekundentod einschätzen zu können, und umfasst die Geschwindigkeit der VES und deren Auftreten, d. h. einzeln oder mehrere aufeinander folgend.

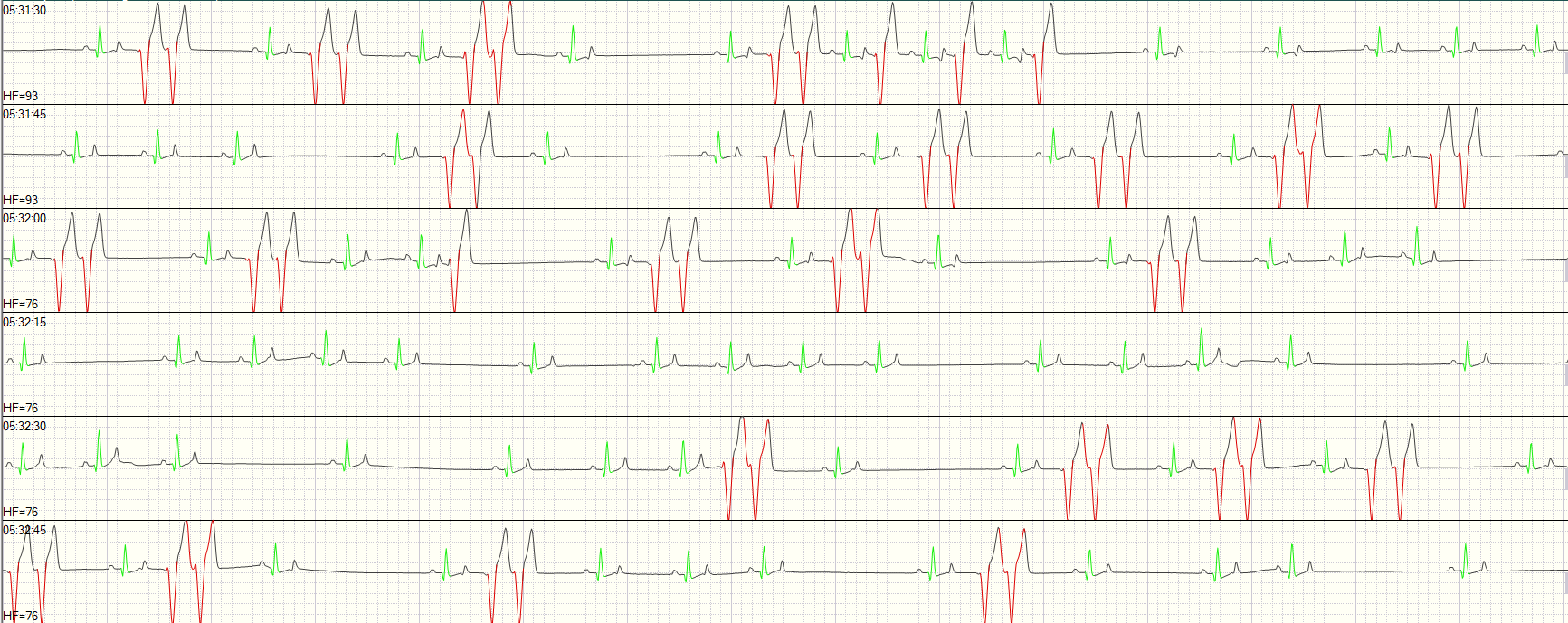
Die Besitzer werden gebeten, während des 24-Stunden-EKGs Tagebuch zu führen. Darin sollen aktive Zeiten ebenso wie Ruhephasen vermerkt werden. Auch besondere Vorkommnisse, sei es die Aufregung, die der Nachbarhund verursacht, oder eine auftretende Synkope, und Medikamentengaben sollen dokumentiert werden. Dies hilft, die Herzfrequenz besser beurteilen zu können. Wenn der Hund aktiv ist, ist ein schnellerer Herzschlag physiologisch; tritt dies jedoch in einer Ruhephase des Hundes auf, kann das ein Hinweis auf eine Pathologie sein.
Da Bubi nach Start der Therapie keine Synkope mehr zeigte und laut Besitzerin weiterhin sehr aktiv war, entschied sie sich aus Kostengründen gegen eine so frühe Kontrolle.
Leider erreichte uns zwei Monate später die Nachricht, dass Bubi am plötzlichen Herztod verstorben sei.
Ob eine Therapieanpassung notwendig gewesen wäre, ob wir Bubis Erkrankung einfach zu spät entdeckt hatten oder ob wir sein frühes Versterben verhindern hätten können, bleibt spekulativ.
Aus meinen bisherigen Erfahrungen weiß ich, wie unterschiedlich die Krankheit verlaufen kann. Das hängt von vielen Faktoren ab, sei es der Zeitpunkt der Entdeckung oder der Verlauf bzw. das Ansprechen auf die Therapie. Die Krankheit ist zwar nicht mit Medikamenten heilbar, jedoch können die klinischen Symptome deutlich gelindert werden, wenn die Therapie regelmäßig gut angepasst wird. Das Risiko, am Sekundentod zu versterben, kann therapeutisch minimiert werden, verhindern lässt es sich aber nicht.
Glücklicherweise durfte ich jedoch auch einige Dobermänner begleiten, die trotz der Erkrankung ein hohes Lebensalter erreichten und bei denen nicht die Herzerkrankung der Grund ihres Ablebens war.
Ätiologie und Pathophysiologie der Dilatativen Kardiomyopathie
Bei der Dilatativen Kardiomyopathie (DCM) ist primär das Myokard, also der Herzmuskel, betroffen. Typisch sind eine verminderte Kontraktilität, eine „Ausdünnung“ des Herzmuskels und eine Volumenüberladung des linken Ventrikels und in Folge ebenso des linken Atriums. Die rechte Seite kann ebenfalls betroffen sein, was jedoch meist erst im fortgeschrittenen Stadium auftritt und nicht bei jedem Tier vorkommt. Zwischen den Herzmuskelzellen kann Fett oder Bindegewebe eingelagert werden oder die Herzmuskelzellen degenerieren und verlieren dadurch ihre physiologische Form.

Bei einigen Rassen ist eine genetische Komponente bekannt. Dazu zählen der Dobermann, aber auch andere große Hunde wie die Deutsche Dogge (Stephenson et al., 2012) oder der Irische Wolfshund (Vollmar, 2000). Der Erbgang ist teilweise bekannt, jedoch ist dieser multifokal und somit nicht auf einen Genlokus begrenzt. Deshalb ist weitere Forschung in diesem Bereich notwendig. Wie auch bei der Mitralklappenendokardiose kann die Erkrankung in verschiedene Stadien (A bis D) eingeteilt werden. Eine genaue Auflistung und Beschreibung ist in den Screening-Guidelines der DCM zu finden.
Auch andere Ursachen können zu einem derartigen Phänotyp führen: Kardiotoxische Medikamente oder ein Taurinmangel können eine systolische Dysfunktion verursachen, diese kann aber auch nutritiv oder Tachykardie-induziert sein. Der Taurinmangel als Ursache wurde unter anderem beim Cockerspaniel und beim Golden Retriever beschrieben (Kittleson et al., 1997; Kaplan et al., 2018). Im Bereich der Ernährung wird derzeit besonders in den USA viel Forschungsarbeit betrieben. Ein hoher Hülsenfruchtanteil steht im Verdacht, negative Effekte auf Herzgesundheit und Kontraktilität beim Hund zu bewirken (Freeman, 2018; Freeman et al., 2022). Eine detailliertere Beschreibung dieser Genese würde den Rahmen dieses Artikels sprengen; die beiden angeführten Studien wurden nur exemplarisch ausgewählt, da mittlerweile eine Vielzahl an Studien verfügbar ist. Darüber hinaus stehen endokrinologische Erkrankungen manchmal im Verdacht, Einfluss auf den Verlauf der DCM zu haben bzw. eine systolische Dysfunktion zu verursachen, was aber bisher in Studien nicht bewiesen werden konnte. Beim Dobermann mit DCM konnte gezeigt werden, dass eine Hypothyreose keinen Einfluss auf den Verlauf der Erkrankung hat (Beier et al., 2015).
Ein im Jahr 2022 im „Journal of Veterinary Cardiology“ veröffentlichter Review informiert über das generelle Screening der DCM und fasst die aktuelle Literatur gut zusammen (Wess, 2022).
Sonderform Dobermann-Kardiomyopathie
Die Dobermann-Kardiomyopathie stellt eine Sonderform der DCM dar. Mittlerweile gibt es zahlreiche Publikationen über Prävalenz, klinischen Verlauf und Malignitätskriterien der Rhythmusstörungen. Die erste Phase der Erkrankung, auch zelluläre Phase genannt, ist nur erkennbar, wenn Herzmuskelzellen unter dem Mikroskop untersucht werden, was aber in der Tiermedizin nicht routinemäßig durchgeführt wird. Eine Besonderheit der Krankheit ist, dass sehr viele der erkrankten Tiere den plötzlichen Herztod erleiden. Etwa ein Drittel der betroffenen Individuen stirbt an Arrhythmien in der zweiten oder okkulten Phase, was bedeutet, dass sie noch keinerlei für den Besitzer erkennbare Symptome zeigen. Ein weiteres Drittel stirbt am Sekundentod in der dritten oder overten Phase, das heißt, diese Tiere zeigen bereits klinische Symptome. Wie lange die einzelnen Phasen dauern, ist je nach Fall unterschiedlich und kann nicht pauschal beantwortet werden.
Die Krankheit ist in der Dobermann-Population sehr weit verbreitet. In Nordamerika wurde eine Prävalenz von 45 bis 63 % festgestellt (O’Grady, 1995; O’Grady MR., 1998), in Europa eine kumulative Prävalenz von 58 %. Männliche Tiere zeigen meist früher echokardiographische Veränderungen, weibliche haben oft über eine längere Zeit nur ventrikuläre Extrasystolen (Wess et al., 2010a).
Im okkulten Stadium können Arrhythmien oder ein meist leises systolisches Herzgeräusch über der Mitralklappe in der klinischen Untersuchung hinweisend sein. In dieser Phase können die Dobermänner jedoch nur durch regelmäßige Screening-Untersuchungen mittels Herzultraschall und Langzeit-EKG diagnostiziert werden. Im Jahr 2017 wurden von der European Society of Veterinary Cardiology Screening-Guidelines beim Dobermann veröffentlicht. Darin werden ein Herzultraschall und ein 24-Stunden-EKG ab einem Alter von drei Jahren empfohlen. Die Untersuchung muss jährlich wiederholt werden, da sich die Krankheit auch im späteren Leben noch entwickeln kann. Hierbei ist die echokardiographische Methode der Wahl die Volumenmessung nach Simpson, bei welcher es mittlerweile rassespezifische Normwerte für den Dobermann gibt.
Sollten die empfohlenen Methoden nicht verfügbar sein oder gibt es finanzielle Einschränkungen, werden eine Bestimmung der Biomarker N-Terminales pro-B-Typ Natriuretisches Peptid (NTproBNP) und cardiales Troponin I (cTNI) sowie ein Kurzzeit-EKG empfohlen (Wess et al., 2017). Auch hier müssen rassespezifische Grenzwerte berücksichtigt werden: Beim Dobermann liegt der Cut-off zum Screening auf DCM für NTproBNP im Vergleich zu anderen Hunderassen niedriger. Hat der Patient einen Wert von > 500 pmol/l, ergeht der Rat zur vollständigen kardiologischen Aufarbeitung mittels Herzultraschall und Langzeit-EKG. Beim cTNI liegt der Cut-off – abhängig vom Testverfahren – bei 0,22 ng/ml (Immulite) bzw. > 0,113 ng/ml (Advia – ultrasensitiv) (Wess et al., 2010b; Wess et al., 2011; Kluser et al., 2019).
Das fünfminütige Kurzzeit-EKG weist eine 64-%-Sensitivität auf, um ein okkultes Stadium zu erkennen (Wess et al., 2010c). Dies ist für einen Screening-Test eigentlich zu niedrig. Da ein Holter-EKG je nach Region jedoch nur eingeschränkt verfügbar ist, kann diese Methode gewählt werden, wenn keine anderen Optionen verfügbar sind.
Das Thorax-Röntgen, welches deutlich häufiger verfügbar ist, hat sich als Screening-Methode als nicht hilfreich erwiesen, da eine systolische Dysfunktion nicht feststellbar ist. Zur Diagnose eines kongestiven Herzversagens kann es jedoch eingesetzt werden. Wie auch bei Biomarkern und den Messwerten im Ultraschall sollten aber auch hier – sofern vorhanden – rassespezifische Normwerte beachtet werden.
Im overten Stadium treten Symptome wie Leistungsschwäche, Husten oder erschwerte Atmung bei einem Herzversagen auf und die Therapie muss entsprechend angepasst werden. Ein Linksherzversagen mit Lungenödem ist häufiger zu beobachten als ein Rechtsherzversagen mit Aszites; beides ist jedoch möglich und kann auch gemeinsam auftreten. Nach Stabilisierung des Herzversagens mittels intensiver Diurese muss schrittweise auf die dauerhafte Entwässerungsdosis reduziert werden. Die Besitzer werden angehalten, täglich die Ruheatemfrequenz zu zählen, um eine erneut auftretende Dekompensation möglichst frühzeitig abfangen zu können. Auch in diesem Bereich wurden Studien erstellt, die die Zuverlässigkeit dieser leicht durchzuführenden und nicht invasiven Methode beweisen (Porciello et al., 2016).
Das Medikament der Wahl bei systolischer Dysfunktion ist Pimobendan, welches in Studien eine verlängerte Überlebenszeit der Tiere gezeigt hat (Summerfield et al., 2012). Ein ACE-Hemmer ist potenziell ebenso vorteilhaft, prospektive Studien fehlen jedoch noch. Bisher gibt es nur eine retrospektive Studie, die eine längere Zeit bis zum Erreichen des Herzversagens zeigt. Die untersuchten Tiere erhielten jedoch kein Pimobendan, da das Medikament zu dieser Zeit noch nicht zugelassen war (O’Grady et al., 2009).
Die Therapie der ventrikulären Rhythmusstörungen ist deutlich komplexer. Durch deren Anwendung kann die linksventrikuläre Funktion gesteigert, das Risiko für eine ventrikuläre Tachykardie bzw. einen plötzlichen Herztod vermindert und eine Verbesserung der klinischen Symptomatik erreicht werden. Die Therapieentscheidung richtet sich nach der Frequenz der Extrasystolen genauso wie nach deren Morphologie und Auftreten – einzeln oder mehrere aufeinander folgend.
Für eine Studie zur Identifizierung von Indikatoren für den plötzlichen Herztod wurden Dobermänner in zwei Gruppen eingeteilt: Die erste erlitt innerhalb von drei Monaten einen Sekundentod, die andere war mehr als zwölf Monate nach Diagnosestellung noch am Leben. In dieser Studie wurden ein vergrößertes Herz, das Vorkommen von ventrikulären Tachykardien, sehr schnellen VES (d. h. eine Frequenz > 260/min) und das Vorliegen von Triplets (drei VES hintereinander) als größte Risikofaktoren für das Erleiden eines Sekundentods identifiziert. Die Therapie war nicht einheitlich und wurde immer individuell angepasst (Kluser et al., 2016).
Die Dobermann-Kardiomyopathie ist eine relativ gut erforschte Herzerkrankung, und mittlerweile gibt es viele eigens für die Rasse erstellte Referenzbereiche. Diese müssen berücksichtigt werden, damit die Diagnose „gesund“ oder „betroffen“ richtig gestellt wird. Trotzdem fehlt es immer noch an Gentests, um die Krankheit frühzeitig mittels Blutuntersuchung diagnostizieren zu können. Ein erfolgversprechender Ansatz in Amerika erbrachte in einer Population in Europa kein signifikantes Ergebnis, weshalb derzeit davon abgeraten wird, Tiere auf diese Weise zu screenen (Owczarek-Lipska et al., 2013). Somit bleibt abzuwarten und zu hoffen, dass in Zukunft valide Tests verfügbar sein werden.
Kernaussagen zur Dilatativen Kardiomyopathie für die Praxis aus den Screening-Guidelines (Wess, 2022):
- Dobermann:
- Jährliches Screening empfohlen ab einem Alter von drei Jahren (Echokardiographie + Holter-EKG)
- Bei Kosteneinschränkung bzw. Nichtverfügbarkeit der empfohlenen Methoden: Kurzzeit-EKG, NTproBNP- und cTNI-Bestimmung
- Ventrikuläre Extrasystolen:
< 50 VES/24 h = unauffällig für DCM, abhängig von deren Komplexität
> 300 VES/24 h = diagnostisch für DCM
zwischen 30 und 300 VES/24 h = auffällig für DCM, Kontrolle nach sechs Monaten
- Screening kann bei folgenden Rassen überlegt werden: Boxer, Cockerspaniel, Deutsche Dogge, Irischer Wolfshund, Neufundländer, Portugiesischer Wasserhund

Mag.med.vet. Doris Bittenecker hat in ihrer dreijährigen Ausbildung zur Kardiologin bei Prof. Dr. Gerhard Wess, Dipl. ECVIM-CA, Dipl. ACVIM, an der Kleintierklinik München eine fundierte Ausbildung in den Bereichen der Echokardiographie, Kurzzeit- sowie Langzeit-EKG-Diagnostik, aktuellen Therapiemethoden und kardialen Notfälle (z. B. Ergusspunktion) erhalten. Zusätzlich hat sie zwei Jahre lang im Notdienst gearbeitet, um ein umfassenderes Wissen zu erlangen. Seit Juli 2023 ist sie als Kardiologin im Diagnostischen Zentrum für Kleintiere von Univ.-Doz. Dr. med. vet. Wolfgang Henninger, Dip.ECVDI, angestellt.
Anschrift: 1140 Wien, Kienmayergasse 47/1; Tel. mobil: +43-664-8924732
Allg. Anfragen: wh@dzk.at
Kardiologische Anfragen: kardio@dzk.at
Website: www.dzk.at
Referenzen
Beier P, Reese S, Holler PJ, Simak J, Tater G, Wess G. The role of hypothyroidism in the etiology and progression of dilated cardiomyopathy in Doberman Pinschers. J Vet Intern Med 2015; 29: 141-9.
Freeman L. Diet-associated dilated cardiomyopathy in dogs –what do we know.pdf. J Am Anim Med Assoc. 2018.
Freeman L, Rush J, Adin D, Weeks K, Antoon K, Brethel S, Cunningham S, Santos LD, Girens R, Goldberg R, Karlin E, Lessard D, Lopez K, Rouben C, Vereb M, Yang V. Prospective study of dilated cardiomyopathy in dogs eating nontraditional or traditional diets and in dogs with subclinical cardiac abnormalities. J Vet Intern Med 2022; 36: 451-63.
Kaplan JL, Stern JA, Fascetti AJ, Larsen JA, Skolnik H, Peddle GD, Kienle RD, Waxman A, Cocchiaro M, Gunther-Harrington CT, Klose T, LaFauci K, Lefbom B, Machen Lamy M, Malakoff R, Nishimura S, Oldach M, Rosenthal S, Stauthammer C, O’Sullivan L, Visser LC, Williams R, Ontiveros E. Taurine deficiency and dilated cardiomyopathy in golden retrievers fed commercial diets. PLoS One 2018; 13: e0209112.
Kittleson MD, Keene B, Pion PD, Loyer CG. Results of the multicenter spaniel trial (MUST): taurine- and carnitine-responsive dilated cardiomyopathy in American cocker spaniels with decreased plasma taurine concentration. J Vet Intern Med 1997; 11: 204-11.
Kluser L, Holler PJ, Simak J, Tater G, Smets P, Rugamer D, Kuchenhoff H, Wess G. Predictors of Sudden Cardiac Death in Doberman Pinschers with Dilated Cardiomyopathy. J Vet Intern Med 2016; 30: 722-32.
Kluser L, Maier ET, Wess G. Evaluation of a high-sensitivity cardiac troponin I assay compared to a first-generation cardiac troponin I assay in Doberman Pinschers with and without dilated cardiomyopathy. J Vet Intern Med 2019; 33: 54-63.
O’Grady M (1995) Outcome of 103 asymptomatic Doberman pinschers: incidence of dilated cardiomyopathy in a longitudinal study, J Vet Internal Med. 199
O’Grady MR, O’Sullivan L, Minors SL, Horne R. Efficacy of benazepril hydrochloride to delay the progression of occult dilated cardiomyopathy in doberman pinschers. J Vet Intern Med 2009; 23: 977-83.
O’Grady MR. HR (1998) The prevalence of dilated cardiomyopathy in Doberman pinschers. Proceedings 16th Annual ACVIM Forum, San Diego, CA
Owczarek-Lipska M, Mausberg TB, Stephenson H, Dukes-McEwan J, Wess G, Leeb T. A 16-bp deletion in the canine PDK4 gene is not associated with dilated cardiomyopathy in a European cohort of Doberman Pinschers. Anim Genet 2013; 44: 239.
Porciello F, Rishniw M, Ljungvall I, Ferasin L, Haggstrom J, Ohad DG. Sleeping and resting respiratory rates in dogs and cats with medically-controlled left-sided congestive heart failure. Vet J 2016; 207: 164-8.
Stephenson HM, Fonfara S, Lopez-Alvarez J, Cripps P, Dukes-McEwan J. Screening for dilated cardiomyopathy in Great Danes in the United Kingdom. J Vet Intern Med 2012; 26: 1140-7.
Summerfield NJ, Boswood A, O’Grady MR, Gordon S, Dukes-McEwan J, Oyama MA, Smith S. Efficacy of pimobendan in the prevention of congestive heart failure or sudden death in Doberman Pinschers with preclinical dilated cardiomyopathy (The PROTECT study). J Vet Intern Med 2012: 1337-49.
Vollmar AC. The prevalence of cardiomyopathy in the Irish wolfhound: a clinical study of 500 dogs. J Am Anim Hosp Assoc. 2000;36(2):125-132.
Wess G, Schulze B, Butz V, Simak J, Killich M, Keller L. Prevalence of dilated cardiomyopathy in doberman pinschers in various age groups. J Vet Intern Med 2010a: 533-8.
Wess G, Simak J, Mahling M, Hartmann K. Cardiac Troponin I in Doberman Pinschers with Cardiomyopathy. J Vet Intern Med 2010b: 843-9.
Wess G, Schulze A, Geraghty N, Hartmann K. Ability of a 5-Minute Electrocardiography (ECG) for predicting arrhythmias in Doberman Pinschers with Cardiomyopathy in Comparison with a 24-Hour ambulatory ECG. J Vet Intern Med 2010c: 367-71.
Wess G, Butz V, Mahling M, Hartmann K. Evalutation of N-terminal pro-B-type natriuretic peptide as a diagnostic marker of various stages of cardiomyopathy in doberman pinschers. AJVR 2011; 72
Wess G, Domenech O, Dukes-McEwan J, Haggstrom J, Gordon S. European Society of Veterinary Cardiology screening guidelines for dilated cardiomyopathy in Doberman Pinschers. J Vet Cardiol 2017; 19: 405-15.
Wess G. Screening for dilated cardiomyopathy in dogs. J Vet Cardiol 2022; 40: 51-68.
