Fortschritte in der bildgebenden Diagnostik –
Computertomographie bei Lungentumoren
Prof. Dr. med. vet. habil. Eberhard Ludewig
(Dipl. ECVDI; FTA für Radiologie, FTA für Kleintiere)
Leiter der Klinischen Abteilung für Bildgebende Diagnostik – Klinik für Kleintiere
Department für Kleintiere und Pferde
Veterinärmedizinische Universität Wien
Ausgabe 04/2022
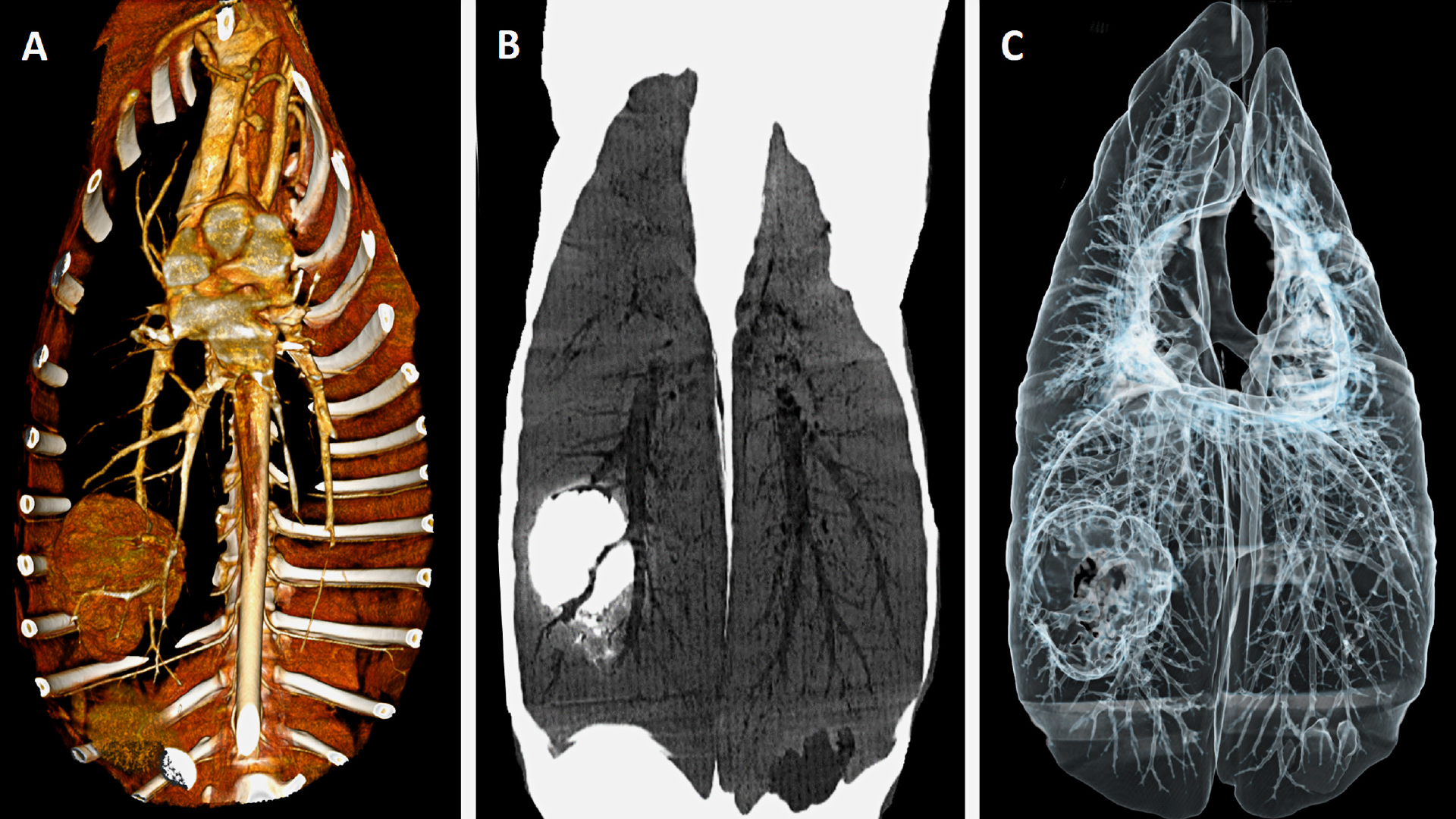
CT-Untersuchung: Rundherde und Massen sind die am häufigsten anzutreffenden Befunde bei Lungentumoren.
Der Einsatz immer leistungsfähigerer Computertomographen und eine stetig wachsende fachliche Expertise haben dazu geführt, dass die CT in der Veterinärmedizin immer breiter eingesetzt wird. Diese Entwicklung wird insbesondere durch die Einführung neuer Therapiemethoden vorangetrieben. Speziell auf dem Gebiet der Onkologie hat der Einsatz einer leistungsfähigen CT zum Erreichen der erzielten Behandlungsfortschritte beigetragen.
Röntgenuntersuchung vs. Computertomographie
Im Vergleich zur Röntgenuntersuchung ist die CT für die Diagnostik von Lungenläsionen besser geeignet. So konnte in Studien gezeigt werden, dass die CT bei „quantitativem“ Nachweis von Lungenveränderungen sensitiver ist und auch bei der „qualitativen“ Einordnung von Läsionen – der Darstellung morphologischer Merkmale – der Röntgendiagnostik überlegen ist (Nemanic et al., 2006, Alexander et al., 2012, Armbrust et al., 2012). Im Wesentlichen liegt das daran, dass mit modernen Tomographen Schnittbilder mit einer hohen örtlichen Auflösung – im Bereich von ein bis zwei Millimetern – erzeugt werden können. Die in transversaler Ebene erzeugten Bilddatensätze können in der Folge in anderen Schnittebenen neu angeordnet werden (multiplanare Reformation) sowie mithilfe von Nachverarbeitungsalgorithmen anderweitig dargestellt (Erzeugung von 3D-Datensätzen) und analysiert werden (spezifische Darstellungen der gemessenen Schwächungsprofile, Abb. 1).
Moderne Computertomographen sind schnell – das heißt, durch kurze Rotationszeiten der Gantry werden immer kürzere Untersuchungszeiten möglich. Dennoch kann bei den meisten Thoraxuntersuchungen nicht auf eine Allgemeinanästhesie verzichtet werden. Das ist ein Grund, warum die Röntgenuntersuchung auch in Zukunft die Basis der bildgebenden Diagnostik bei thorakalen Veränderungen bleiben wird. Für Röntgenuntersuchungen sprechen weiterhin die flächendeckende Verfügbarkeit der Technik und ihre geringeren Kosten sowie der Umstand, dass bei vielen Erkrankungen Röntgenbilder hinreichend genaue Informationen liefern und somit keine Notwendigkeit für eine Schnittbilddarstellung besteht.
Eine computertomographische Untersuchung ist bei Patienten angezeigt, bei denen aufgrund bisher vorliegender Befunde richtungsweisende Konsequenzen für eine weiterführende Diagnostik (Feinnadelaspiration, Biopsie, tracheobronchiale Lavage, Endoskopie) oder das therapeutische Vorgehen zu erwarten sind. Ziel dieser Übersicht ist es, wesentliche Merkmale, der Lungentumoren im CT-Bild zu kennzeichnen und zusammenzufassen. Gleichzeitig soll das Potenzial des Verfahrens verständlich gemacht werden.
Erscheinungsformen von Lungentumoren
Häufige primäre Lungentumore sind Adenokarzinome, Plattenepithelkarzinome, histiozytäre Sarkome, Lymphosarkome und Tumoren bronchialen Ursprungs. Zudem sind Metastasen vieler Tumoren in der Lunge nachweisbar, häufig solche von Hämangiosarkomen, Osteosarkomen, Schilddrüsenkarzinomen und Mammakarzinomen (Kessler, 2022). In beiden Gruppen manifestieren sich Lungentumoren in der CT meist als weichteildichte Rundherde oder Massen unterschiedlicher Größe und Anzahl.
Als Masse werden per definitionem Läsionen von mehr als drei Zentimetern bezeichnet (Abb. 1). Auch kleine Herde mit Durchmessern von ein bis zwei Millimetern sind auf CT-Bildern meist gut erkennbar (Abb. 2).
Gelegentlich weisen Lungentumoren Mineralisationen auf, häufiger betrifft das Tumoren bei Katzen. Bei großen Massen sind häufig in den zentralen Bereichen Gas- und Flüssigkeitseinlagerungen nachweisbar (Marolf et al., 2011, Schwarz und Johnson, 2011, Aarsvold et al., 2015). Größe, Zahl und Verteilung der Rundherde variieren sehr und erlauben kaum eine Einordnung der identifizierten Strukturen als Primärtumor oder Metastase sowie die Abgrenzung von nicht tumorösen Veränderungen. Neben Rundherden und Massen können sich pulmonale Tumoren in selteneren Fällen auch als sogenannte Parenchymveränderungen präsentieren. Dabei handelt es sich um flächige Veränderungen mit alveolärem, broncho-interstitiellem oder gemischtem Strukturmuster (Marolf et al., 2011, Abb. 2).
Grundsätzlich ist die endgültige Diagnosestellung nur im Rahmen pathohistologischer oder zytologischer Untersuchung möglich. Allerdings werden bei einzelnen Entitäten bestimmte Befundmuster häufiger gefunden. In diesen Fällen ist es möglich, auf der Grundlage bildmorphologischer Merkmale Aussagen zur erwarteten Dignität zu machen:
• singuläre Läsionen bei primären Lungentumoren (Marolf et al., 2011, Barrett et al., 2014)
– bei Katzen häufig Massen oder kavernöse Läsionen in den kaudodorsalen Lungenabschnitten (Aarsvold et al., 2015)
– bei histiozytären Sarkomen oftmals Massen im rechten Mittellappen und rechten Kraniallappen (Tsai et al., 2012, Barrett et al., 2014)
• multiple Rundherde in kleiner Zahl bei Metastasen mesenchymaler Tumoren (hämatogene Metastasierung) (Kessler, 2022)
• multiple Rundherde in großer Zahl bei Metastasen epithelialer Tumoren (lymphogene Metastasierung) (Kessler, 2022)
• regionale Bronchialwandverdickung und Invasion in das Lumen bei Tumoren bronchialen Ursprungs (Marolf et al., 2011, Aarsvold et al., 2015)
• zahlreiche flüssigkeitsgefüllte Zysten mit Läppchenstruktur bei zystischen Adenokarzinomen (Schwarz und Johnson, 2011)
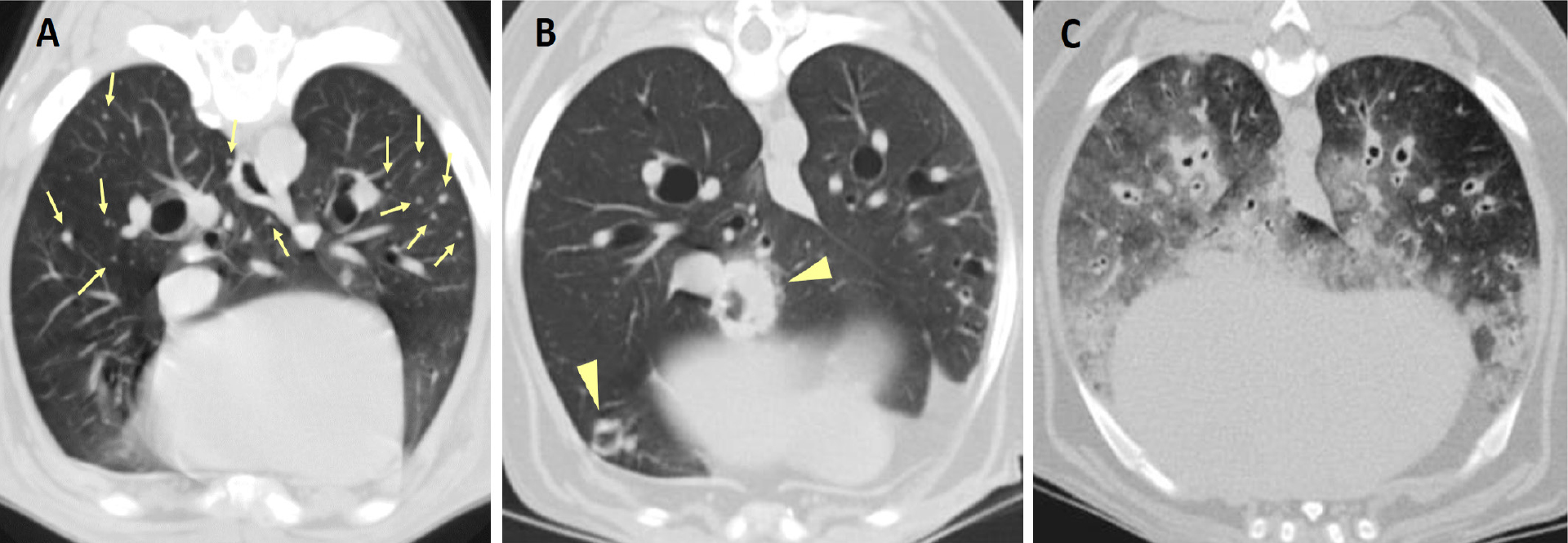
Begleitende Veränderungen
Sekundäre Veränderungen sind häufig und stehen in Zusammenhang mit der Expansion des Tumors bzw. der Metastasierung. Diese sekundären Veränderungen manifestieren sich in Form zusätzlicher Befunde oder Lungentumoren werden durch sie maskiert. Derartige begleitende Veränderungen sind:
• Atelektasen durch Kompression der bzw. Invasion von Bronchien durch den Tumor (Schwarz und Johnson, 2011)
• Veränderungen der Lungenstruktur durch Blutungen, Nekrosen oder Infektionen (Schwarz und John-son, 2011)
• Kavernenbildung infolge zentraler Nekrosen bei großen Läsionen (Abb. 2B) (Parry et al., 2021)
• Pleurale Massen, Liquidothorax bzw. Pneumothorax durch Invasion oder Metastasierung in den Pleuraraum (Marolf et al., 2011, Aarsvold et al., 2015)
• Veränderungen durch intra- und extrathorakale Metastasierung (u. a. Lymphadenomegalie, Metastasen primärer Lungentumoren in der Lunge bzw. in den Knochen der Zehen) (Marolf et al., 2011)
• Hypertrophe Osteopathie (Akropachie) (Schwarz und Johnson, 2011)
Differenzialdiagnosen
Die Liste der Differenzialdiagnosen für pulmonale Tumoren, die sich als Rundherd oder Masse präsentieren, umfasst im Wesentlichen granulomatöse Veränderungen (eosinophile bzw. lymphomatoide Granulome, Mykosen, Tuberkulose) und Abszesse (Schwarz und Johnson, 2011, Fina et al., 2014, Mesquita et al., 2015); hingegen sind Zysten und Hämatome in der CT als Strukturen mit moderater Wanddicke und flüssigem Inhalt gut von kompakten Läsionen abgrenzbar.
Zusammenfassung
CT-Untersuchungen des Thorax sind wichtige Voraussetzungen für die Planung komplexer onkologischer Therapien. Lungenveränderungen spielen dabei eine wichtige Rolle. Im Artikel wird der Versuch unternommen, den aktuellen Wissensstand zusammenzufassen: Rundherde und Massen sind die am häufigsten anzutreffenden Befunde bei primären Tumoren und Metastasen der Lunge. Seltener gehen pulmonale Tumoren mit flächigen Verdichtungen des Lungenparenchyms einher. Für einige Tumorentitäten sind bildmorphologische Befundmuster beschrieben, anhand derer relativ zuverlässig ein Tumor histopathologisch eingeordnet werden kann. Zu berücksichtigen ist, dass Tumoren durch eine Reihe weiterer Veränderungen begleitet oder überlagert werden können. Sowohl herdförmige Läsionen als auch flächige Veränderungen finden sich jedoch auch bei nicht tumorösen Erkrankungen, was ebenfalls die Einordnung erschweren kann. Für die Zukunft ist zu erwarten, dass Methoden der künstlichen Intelligenz und des maschinellen Lernens die Bildauswertung auch in der veterinärmedizinischen CT unterstützen werden.
Literaturliste:
Aarsvold S, Reetz JA, Reichle JK et al., Computed tomographic findings in 57 cats with primary pulmonary neoplasia. Vet Radiol Ultrasound 56; 2015: 272–277.
Alexander K, Joly H, Blond L., A comparison of computed tomography, computed radiography and film-screen radiography for the detection of canine pulmonary nodules. Vet Radiol Ultra-sound 53; 2012: 258–265.
Armbrust LJ, Biller DS, Bamford A et al., Comparison of three-view thoracic radiography and computed tomography for detection of pulmonary nodules in dogs with neoplasia.
J Am Vet Med Assoc 240; 2012: 1088–1094.
Barrett LE et al., Radiographic characterisation of primary lung tumor in 74 dogs. Vet Radiol Ultrasound 2014; 55: 480–487.
Fina C, Vignoli M, Terragni R et al., Computed tomographic characteristics of eosinophilic pulmonary granulomatosis in five dogs. Vet Radiol Ultrasound 55; 2014: 16–22.
Kessler, M., Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hund und Katze. Stuttgart, Thieme 2022.
Marolf AJ, Gibbons DS, Podell PK et al., Computed tomographic appearance of primary lung tumors in dogs. Vet Radiol Ultra-sound 52; 2011: 168–172.
Mesquita L, Lam R, Lamb CR et al., Computed tomographic findings in 15 dogs with eosinophilic bronchopneumopathy.
Vet Radiol Ultrasound 56; 2015: 33–39.
Nemanic S, London CA, Wisner ER., Comparison of thoracic radiographs and single breathhold helical CT for detection of pulmonary nodules in dogs with metastatic neoplasia. J Vet Intern Med 20; 2006: 508–515.
Parry M, Selmic LE, Lumbrezer-Johnson S et al., Computed tomographic characteristics of cavitary pulmonary adenocarcinoma in 3 dogs and 2 cats. Can Vet J 62; 2021: 719–724.
Schwarz T, Johnson V., Lungs and Bronchi. In: Schwarz T, Saunders J. (Eds.)., Veterinary Computed Tomography.
Oxford, Wiley-Blackwell 2011, 261–277.
Tsai S, Sutherland-Smith J, Burgess C et al., Imaging characteristics of intrathoracic histiocytic sarcoma in dogs.
Vet Radiol Ultrasound 53; 2012: 21–27.
