Leistungsverlust bei Mastschweinen
Konsequenzen chronischer Darminfektionen
Mag. med. vet. Anna Maria Gager, BA, Dr. Christine Unterweger, DIPL. ECPHM
Universitätsklinik für Schweine, Veterinärmedizinische Universität Wien
Ausgabe 10/2020
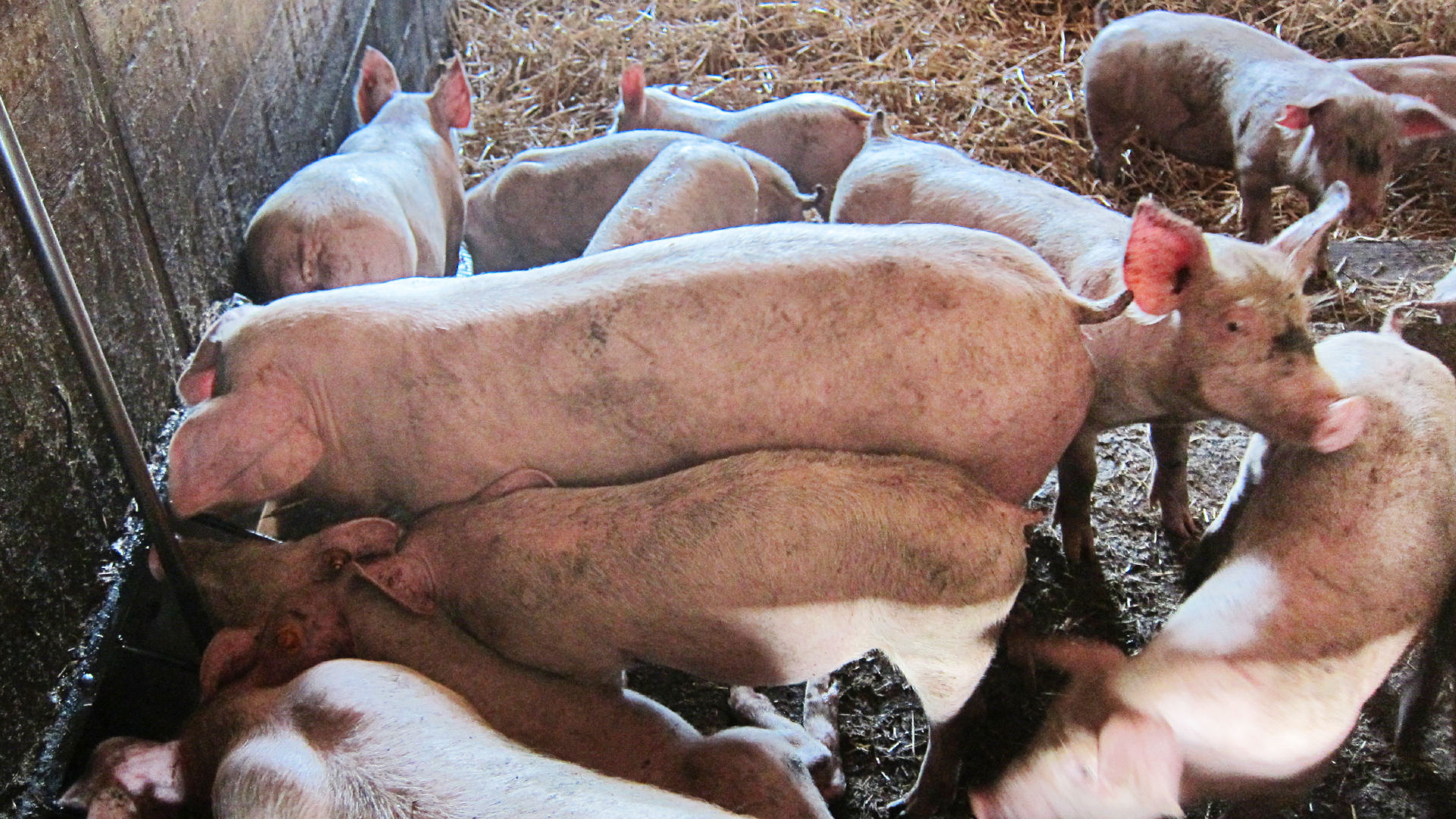
Mastschweine sollen in kürzester Zeit ohne große Zusatzkosten ein optimales Schlachtgewicht erreichen können – frühzeitige Diagnose und Therapie von Darminfektionen sind daher Gold wert.
Abmagerung, verminderte Tageszunahmen, längere Mastdauer, in der Folge Platzprobleme und hohe Tierarzt- sowie Futterkosten – ein Szenario, von dem viele Landwirte und Tierärzte zu berichten wissen. Darminfektionen, vor allem jene ohne typische Durchfallsymptomatik, die sich erst im Laufe der Mast durch Auseinanderwachsen „outen“ – insbesondere durch Bakterien wie Lawsonia intracellularis, Brachyspira spp. oder Salmonella spp. verursachte – werden oft als Ursache beschrieben.
Obwohl sich eine chronische Infektion aus unserer Sicht auf einen definierten Erreger unter Einbeziehung der Klinik und histologischen Läsionen bezieht, wird in der Literatur häufig von chronischen Darminfektionen gesprochen, wenn oben genannte Symptomatik auftritt. Die Ansichten dazu sind kontrovers; in der Bestandsbetreuung versteht man unter chronischen Darmerkrankungen auch jene, die im Bestand manifest sind und beispielsweise in der Mast regelmäßig auftreten – allerdings auch in perakuter, akuter und subklinischer Form.
Im Gegensatz zu den „akuten infektiösen Darmerkrankungen“ beim Schwein, klassischerweise durch Diarrhoe und sämtliche Folgeerscheinungen erkennbar, werden chronische Darmerkrankungen oft erst spät erkannt, insbesondere, wenn vorher keine akuten erkennbaren klinischen Symptome aufgetreten sind. In weiterer Folge sind auch die Diagnostik und Therapie erschwert. Nachdem Tiere gewünscht werden, die in kürzester Zeit ohne große Zusatzkosten ein optimales Schlachtgewicht erreichen können, sind eine frühzeitige Diagnose und gut überlegte Therapie – und in weiterer Folge Prophylaxe – Gold wert.
In der Literatur werden als Ursache von verminderten Tageszunahmen und Leistungseinbußen in erster Linie die chronischen Verlaufsformen von Infektionen mit Lawsonia intracellularis, Brachyspira spp. und Salmonella spp. genannt, aber auch ein hochgradiger Befall mit Endoparasiten (z. B. mit Ascaris suum) oder eine Infektion mit dem Porcinen Circovirus 2 kann zum selben klinischen Bild führen. Viel zu wenig weiß man auch noch über nicht infektiöse Ursachen, wie z. B. Reizdarm und Störungen infolge eines gestörten Mikrobioms, worauf hier auch nicht weiter eingegangen werden soll.
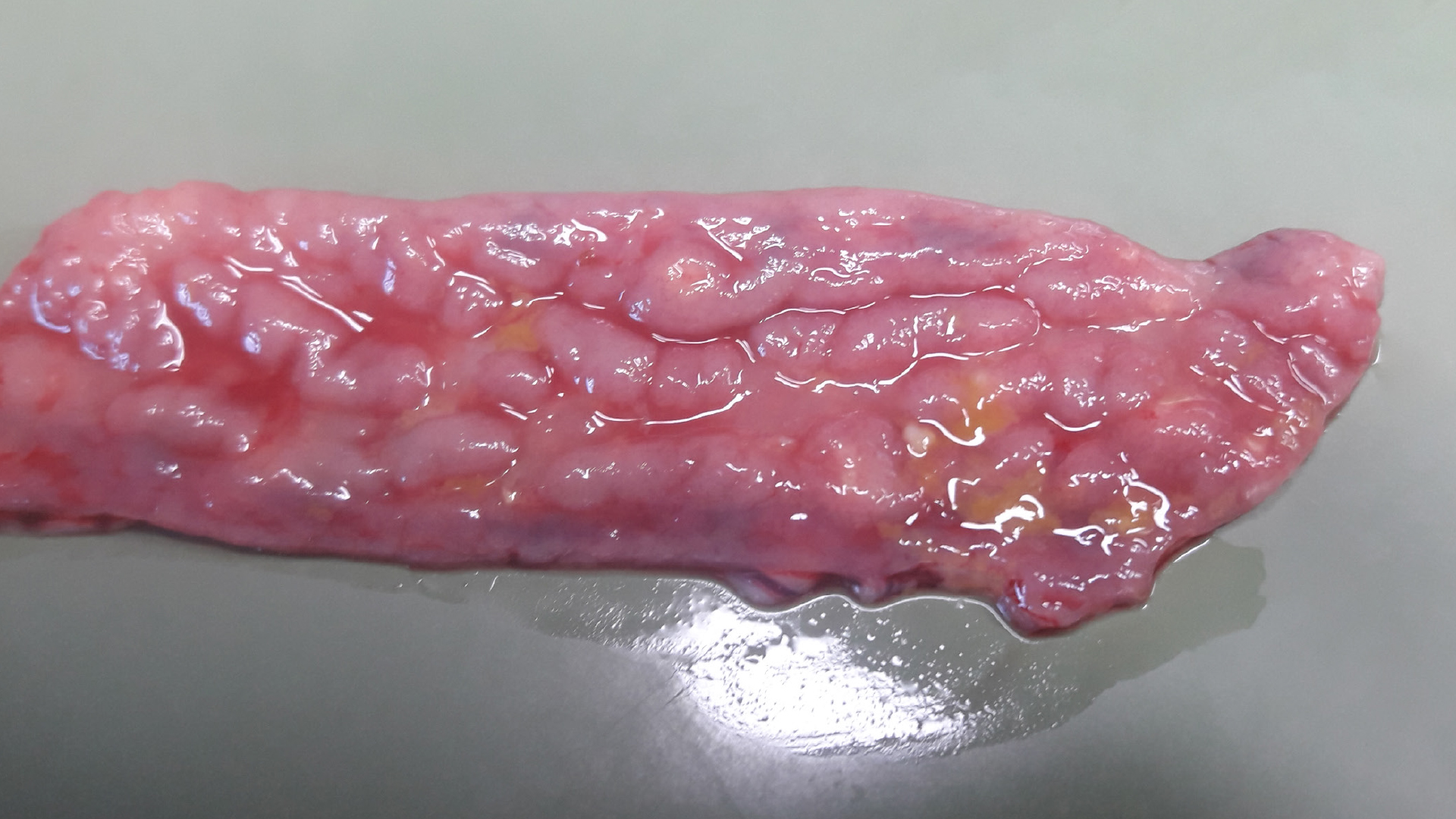
Lawsonia intracellularis, ein gramnegatives, strikt intrazelluläres, weltweit vorkommendes Bakterium, wird fäkal-oral übertragen. Als Zielzellen fungieren die Enterozyten, insbesondere jene des Ileums, sporadisch jedoch auch des Jejunums, Caecums und Colons, die infolge nicht mehr reifen. Die krankhafte Vermehrung unreifer Enterozyten, konsekutive Verdickung der Darmschleimhaut und gleichzeitiger Verlust der Becherzellen resultieren in der subklinischen bzw. chronischen Manifestationsform PIA (Porzine Intestinale Adenomatose), abzugrenzen von der akuten hämorrhagischen Form PHE (Proliferative Hämorrhagische Enteropathie). Oft lässt sich die PIA schon makroskopisch durch die klassischen tiefen, hirnwindungsartigen Schleimhautfalten erkennen. Histologisch zeigen sich eine Proliferation und Hypertrophie unreifer Enterozyten. In manchen Fällen ist eine Weiterentwicklung zur Nekrotisierenden Ileitis (NE), charakterisiert durch (multi-)fokale Nekrosen, oder zur Regionalen Ileitis (RE) mit den durch massive Muskularis-Hypertrophien verursachten gartenschlauchähnlichen Verdickungen im Ileum möglich.
Der kulturelle Nachweis ist nur in der Zellkultur möglich und wird daher in der Routine nicht durchgeführt. Daher erfolgt ein Nachweis mittels molekularbiologischer Methoden, bevorzugt aus Ileumschleimhaut, alternativ aus Kot. An der Vetmeduni Vienna wird routinemäßig eine Triplex-PCR durchgeführt, welche den gleichzeitigen Nachweis von Lawsonia intracellularis, Brachyspira (B.) hyodysenteriae und B. pilosicoli aus dem Geschabsel von Ileum- und Colonschleimhaut ermöglicht.
Die zwei in Österreich bedeutungsvollsten Vertreter der Brachyspiraceae – B. hyodysenteriae, Erreger der Schweinedysenterie, und B. pilosicoli, der Erreger der Porzinen Intestinalen Spirochätose – sind klinisch kaum voneinander zu unterscheiden, jedoch zeigt B. pilosicoli üblicherweise mildere Symptome bzw. einen milderen Verlauf. Nach fäkal-oraler Infektion besiedelt B. hyodysenteriae die Mukosa, insbesondere die Becherzellen und die Krypten des Colons. Durch den Befall von Becherzellen und Enterozyten kommt es zu einer vermehrten Schleimproduktion und Epithelverlust, resultierend in Malabsorption. B. pilosicoli heftet sich an die reifen Epithelzellen der Krypten – dadurch entsteht der klassische „falsche Bürstensaum“ (zahlreiche Spirochäten liegen nebeneinander). Die genauen zugrunde liegenden Pathomechanismen sind jedoch noch nicht eindeutig geklärt. Als direktes Nachweisverfahren haben sich PCR-Methoden als sehr zuverlässig gezeigt, da damit auch das Genom bereits abgestorbener Brachyspiren nachzuweisen ist, während für eine Isolierung lebende Bakterien erforderlich sind. Da sich in Österreich derzeit die direkte kulturelle Anzucht in der Routinediagnostik aufgrund ihrer speziellen Wachstumsbedürfnisse als schwierig erweist, wird das Probenmaterial (Kot oder Darm, luftdicht verschlossen) im Bedarfsfall an spezialisierte Labors in Deutschland weitergeleitet, insbesondere, wenn Resistenztests durchgeführt werden müssen.
Salmonella spp., ein gramnegatives, fakultativ intrazelluläres Stäbchenbakterium, ist weltweit verbreitet, die Prävalenz ist in österreichischen Schweinebetrieben im Gegensatz zu anderen EU-Ländern jedoch sehr gering. Klinisch relevant beim Schwein sind nur die Serovare S. choleraesuis, S. typhimurium und S. typhisuis. Der chronische Verlauf einer S.-typhimurium-Infektion kann bei einzelnen Schweinen eine ulzerative Proktitis hervorrufen, die in weiterer Folge eine Rektumstenose begünstigt. Ein typisches Symptom ist oft der auftretende Trommelbauch. Die Tiere zeigen vermehrte Fressunlust, was zur Abnahme der Tageszunahmen bis zu Gewichtsverlust führt. Da Salmonella spp. diskontinuierlich ausgeschieden werden – wobei Stress als Trigger fungieren kann –, ist der kulturelle Direktnachweis am lebenden Tier nicht immer zuverlässig.
Kontrolle
Gerade chronische Formen dieser Krankheiten können mit alleiniger antibiotischer Therapie nicht auf -Dauer in den Griff bekommen werden und müssen Hand in Hand mit der Optimierung der Biosecurity- und Hygienemaßnahmen gehen. Behandlungen erfolgen im Regelfall übers Futter oder Wasser. Aufgrund der Schwierigkeiten, L. intracellularis anzuzüchten, sind Resistenzprüfungen nicht möglich, Resistenzen scheinen jedoch zumindest in vivo kein Problem darzustellen. Wichtig ist, dass sich die Antibiotika intrazellulär anreichern können. Bei Brachyspiren-Infektionen erfolgt die Behandlung vor allem mit Antibiotika der Gruppen Pleuromutiline, Makro-lide und Lincosamide. Resistenzen gegen grundsätzlich wirksame Antibiotikagruppen sind häufig beschrieben, daher ist zumindest nach ausbleibendem Therapieerfolg die Durchführung von Resistenztests angezeigt. Salmonellen-Infektionen werden laut Antibiogramm behandelt, mittlerweile sind auch multiresistente Stämme sowie plasmidvermittelte Resistenzen bekannt.
Parallel muss eine generelle konsequente Fehleranalyse betrieben werden, um sämtliche Übertragungswege zu erfassen und in Folge abstellen zu können. Fehlerquellen stellen oft Reinigung und Desinfektion, Schädlings- und Schadnagerbekämpfung oder das Prozedere des Pig-flows dar. Im Fall von Lawsonien- und Salmonellen-Infektionen können auch kommerziell erhältliche Impfstoffe bereits im Saugferkelalter eingesetzt werden; diese Möglichkeit gibt es bei Brachyspiren-Infektionen bis dato nicht.
Fazit
Weiterhin herausfordernd sind neben den oft nicht zufriedenstellenden diagnostischen Möglichkeiten die Opti-mierungen der Biosecurity sowie des Managements, insbesondere in Betrieben ohne Rein-raus-Verfahren oder Desinfektionsmöglichkeiten. Salmonellen-Infektionen scheinen in der österreichischen Schweinemast eine untergeordnete Rolle zu spielen.
