Zecken-übertragene Erkrankungen
beim Hund (Teil 2)
DR. MED.VET Nikola Pantchev 1, Dr. rer. nat. Silvia Pluta 1, DR. MED.VET Elke Huisinga 1, DR. MED.VET Stephanie Nather 1, DR. MED.VET Miriam Scheufelen 1, DR. MED.VET Majda Globokar Vrhovec 1, DR. MED.VET Andrea Schweinitz 1, DR. MED.VET Herwig Hampel 1, Prof. DR. MED.VET Reinhard K. Straubinger 2
1 IDEXX Laboratories, 2 Ludwig-Maximilians-Universität München
Ausgabe 05/2017
Borreliose, Anaplasmose, Babesiose: Diagnostik.
Lyme-Borrelien
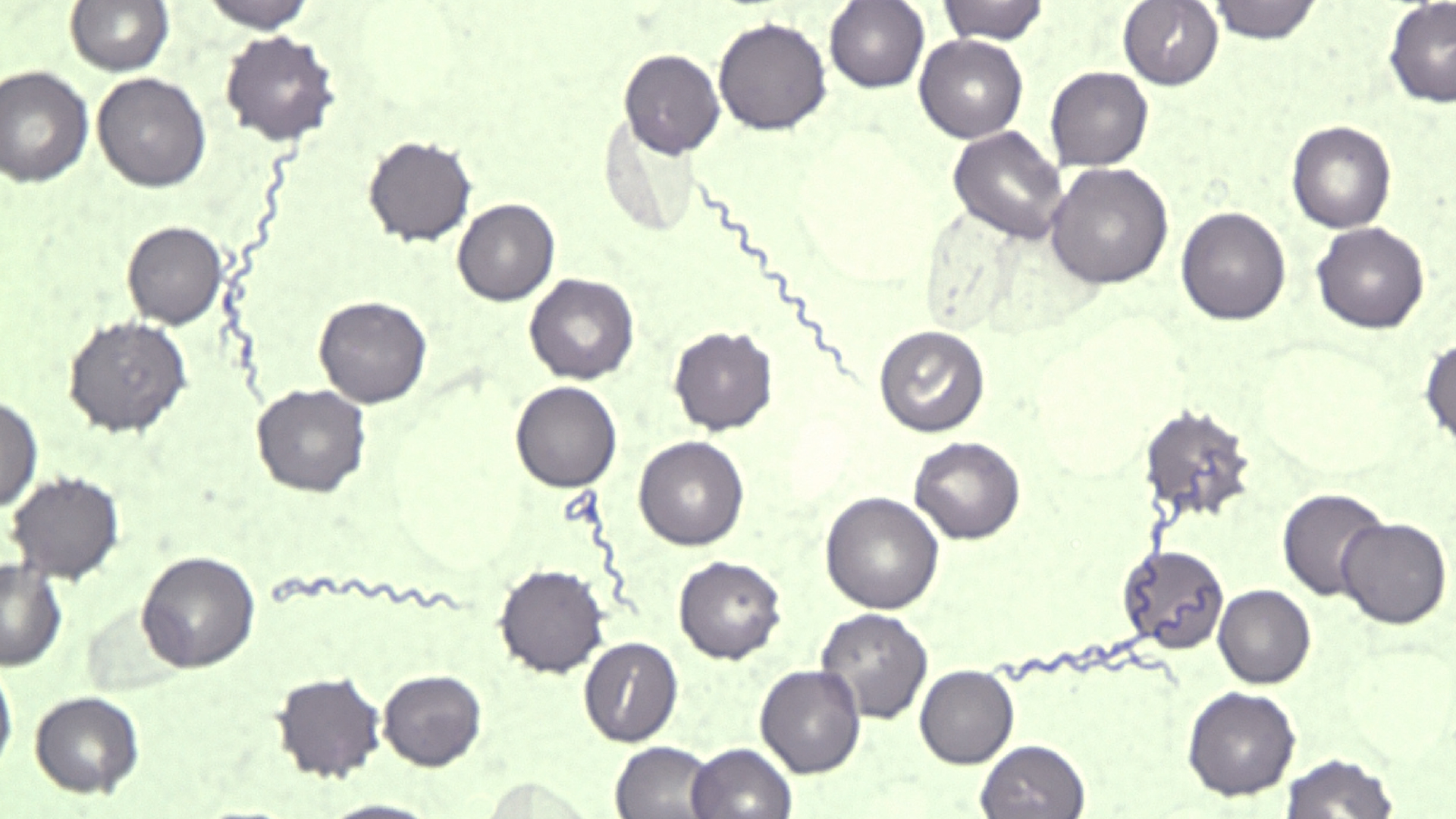
Die Verdachtsdiagnose „Lyme-Borreliose“ beim Hund schließt mehrere Kriterien ein (Littman et al. 2006; Krupka & Straubinger 2010). Das sind eine Anamnese hinsichtlich Zeckenexposition und Leben in einem Endemiegebiet, diagnostische Hinweise auf eine Infektion mit dem Erreger, Ausschluss von Differenzialdiagnosen, passende klinische Symptome sowie Ansprechen auf spezifische Behandlung inklusive Therapiekontrolle. Der Nachweis mittels direkter Methoden (PCR/Kultur) ist schwer und wenig praktikabel. Lyme-Borrelien werden sehr selten in „Flüssigkeiten“ wie Blut (Abb. 1), Urin (selten auch Blasenbeteiligung), Gelenksflüssigkeit oder Liquor und häufiger in Bindegewebe, Gelenkkapseln (der Nachweis gelingt nicht in allen betroffenen Gelenken), Haut (nahe des Zeckenstichs), Lymphknoten, Muskel (auch Herz) u. a. nachgewiesen (aber oft in niedriger Kopienzahl zum Zeitpunkt des Nachweises) (u. a. Chou et al. 2006).
In der Human- und Veterinärmedizin setzt sich kontinuierlich der Nachweis Borrelien-spezifischer Antikörper mittels des C6-Peptids durch (Liang et al. 1999a; Embers et al. 2007; Wagner et al. 2012), weil dieser Vorteile gegenüber anderen Methoden bietet. Das C6-Peptid ist Teil des VlsE-Proteins von B. burgdorferi und ist konserviert innerhalb verschiedener Borrelien-Arten (Liang et al. 2000a). IR6 („conserved“ Peptid = C6) ist eine von sechs nicht variablen Regionen (IR1–IR6) innerhalb der zentralen variablen Domäne und präsentiert sich als das immundominanteste unter ihnen (Liang et al. 1999b; Embers et al. 2007). Die Vorteile C6-basierter Tests gegenüber bisherigen Methoden (IgM/IgG-ELISA/IFAT) sind, dass das Antigen nicht mit Impfantikörpern (O’Connor et al. 2004; Goldstein et al. 2007) oder mit Antikörpern gegen andere Spirochäten wie etwa Leptospiren kreuzreagiert (Liang et al. 2000b). Spezifische C6-Antikörper stellen zudem einen frühen und robusten Marker einer Infektion ab 21 bis 35 Tagen p. i. dar (Wagner et al. 2012) und persistieren für mindestens zwölf Monate in unbehandelten Hunden (Philip et al. 2001; Levy et al. 2008). Nach Behandlung fällt die C6-Antikörperkonzentration innerhalb von drei bis sechs Monaten ab. Es wurde ein Abfall um mehr als 58,3 % nach sechs Monaten bei Tieren mit einer Ausgangskonzentration von mehr als 29 U/ml festgestellt (Levy et al. 2008), während die Werte von ganzzellbasierten Tests nicht in dem Maße sanken (Straubinger 2000; Straubinger et al. 2000; Philip et al. 2001). Die letzten zwei Punkte, Persistenz der Antikörper und Abfall nach Therapie, deuten darauf hin, dass C6-Antikörper als ein Marker einer aktiven Infektion angesehen und zur Therapiekontrolle herangezogen werden können, wie dies auch bei experimentell infizierten Affen gezeigt werden konnte (Philip et al. 2001; Embers et al. 2012).
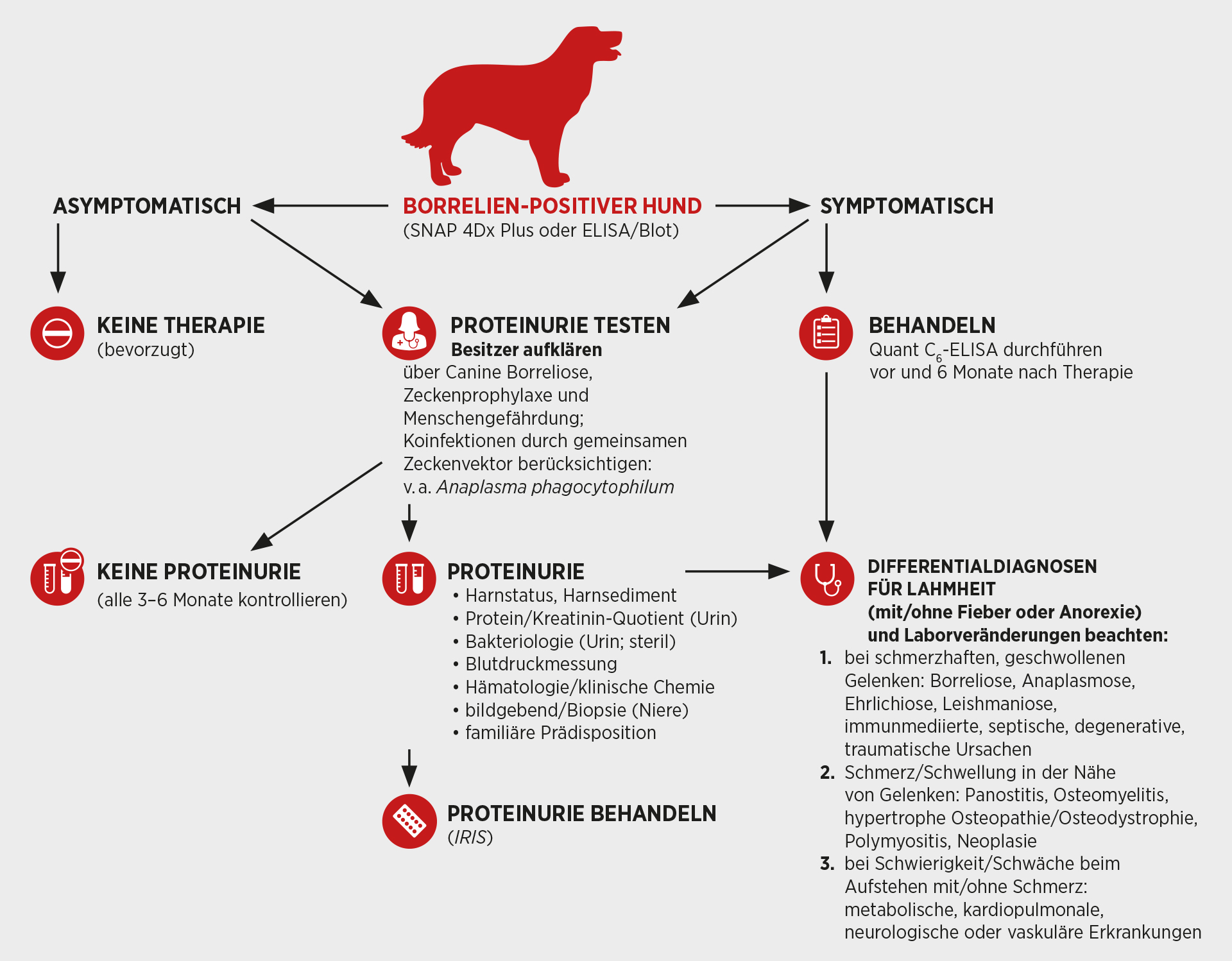
Wie in Abb. 2 zu sehen, erscheint es wichtig, bei Borrelien--infizierten Tieren abzuklären, ob eine Proteinurie vorliegt. Angenommen wird eine mit Borrelien in Zusammenhang stehende Nierenerkrankung, die als „Lyme-assoziierte Proteinverlust-Nephropathie“ oder „Lyme-Nephritis“ (LN) bezeichnet wird (Dambach et al. 1997; Chou et al. 2006; Littman 2013). LN wird auch als Ausdruck einer rassebedingten, hereditären Glomerulopathie angesehen, bei der sich Borrelien-spezifische Immunkomplexe auf einer vorgeschädigten Basalmembran ablagern und so erst eine klinisch apparente Nierenerkrankung auslösen können (Littman 2013, 2015; Horney & Stojanovic 2013). Hunde mit einer C6-spezifischen Antikörperkonzentration von über 30 U/ml weisen ein signifikant erhöhtes Risiko für Proteinurie (UPC > 0,5) auf (Tab. 1).
Hunde mit erhöhtem UPC in der Gruppe 3 (Tab. 1) waren zudem jünger (5,5 Jahre) als Hunde mit erhöhtem UPC in den Gruppen 1 und 2 (7,9 Jahre). Der UPC-Median betrug 6,5 in der Gruppe 3 versus 1,4 in den Gruppen 1 und 2. 21 von 35 Hunden in der Gruppe 3 hatten zudem Quant C6-Werte über 100 U/ml. Eine aktuelle Untersuchung konnte auch einen Zusammenhang zwi-schen dem Quant C6-Wert bei Hunden mit Verdacht auf Lyme-Borreliose und einer erhöhten SDMA-Konzentration im Serum bestätigen (Nather et al. 2016). Hunde mit einem Quant C6-Wert über 100 U/ml wiesen in 55 %
der Fälle eine erhöhte SDMA-Konzentration (>14 µg/dl) auf, wohingegen bei Quant C6-Werten <30 und 30–100 der SDMA-Wert bei nur 22 % bzw. 26 % der Proben erhöht war (signifikanter Unterschied). Diese Daten deuten darauf hin, dass C6-spezifische Antikörper und insbesondere eine Konzentration über 100 U/ml bei entsprechender Anamnese als Marker einer LN in Betracht kommen.
Anaplasma phagocytophilum
Die Kriterien für die Diagnose einer CAG (Canine Granulozytäre Anaplasmose) beinhalten Zeckenkontakt/Bluttransfusion mit klinischen Veränderungen oder Blutbildauffälligkeiten, positive PCR/Morulae in Neutrophilen oder einen vierfachen Antikörperanstieg innerhalb von vier Wochen (Kohn et al. 2008). Es scheint keine Rasseprädisposition vorzuliegen, evtl. aber eine Altersprädisposition. So waren in den USA 35,3 % der betroffenen Hunde zwischen acht und zehn Jahre, 58,8 % mindestens sechs Jahre und nur 11,7 % unter ein Jahr alt (Greig et al. 1996). In einer schwedischen Studie waren rund ein Drittel der Hunde über neun Jahre und kein Patient unter ein Jahr (Egenvall et al. 1997). Es besteht eine saisonale Häufung und zwar parallel zum Aufkommen von Zecken von April bis September (Kohn et al. 2008; Carrade et al. 2009).
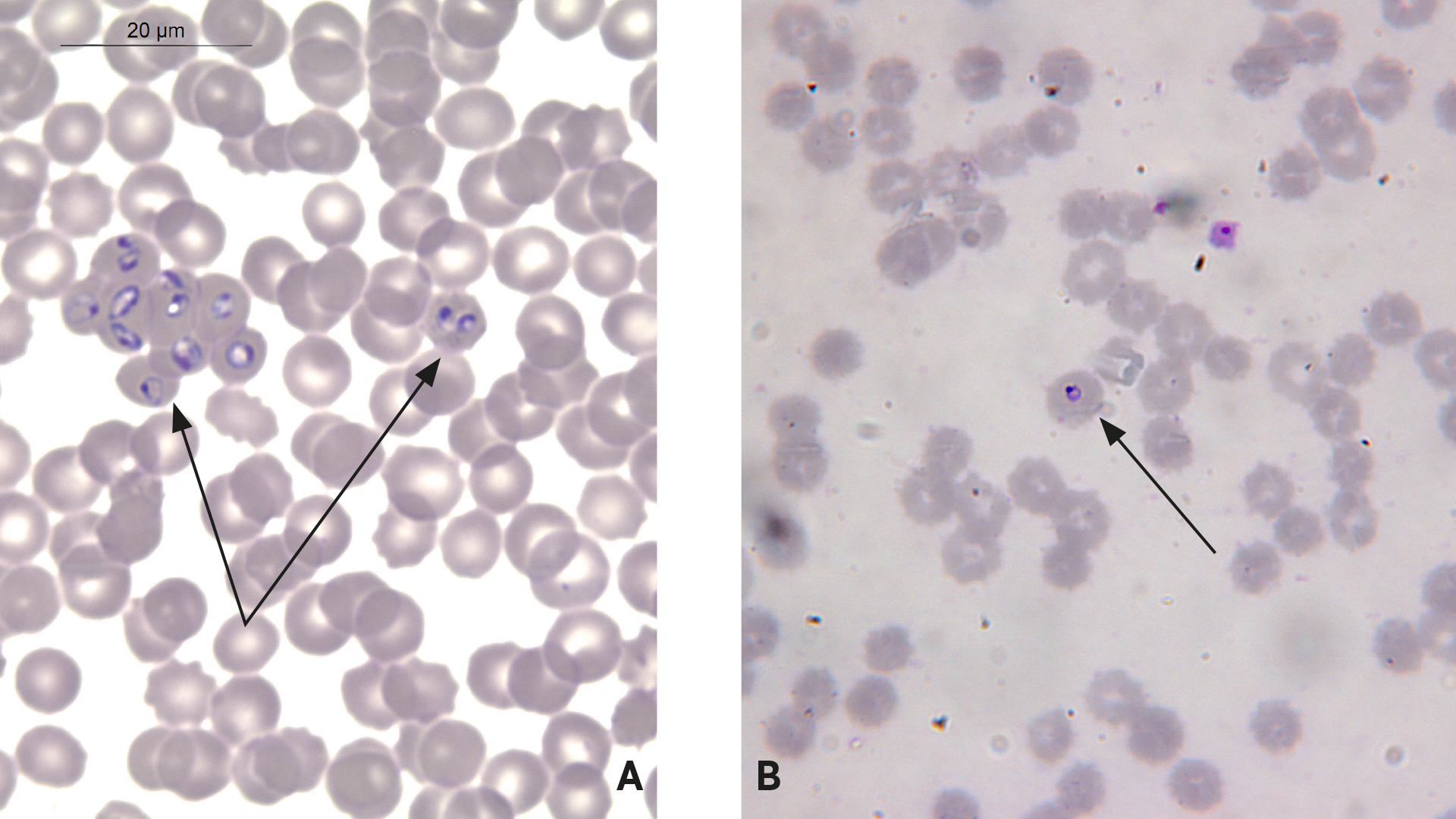
Die charakteristischen Abweichungen in der Hämatologie/-klinischen Chemie sowie die Möglichkeiten spezifischer Diagnostik werden anhand von drei Fallbeispielen in Tab. 2 dargestellt. Vielversprechend ist die Messung des C-reaktiven Proteins (CRP), das in der akuten Phase der Erkrankung bis zu zehnfach erhöht sein kann (Pantchev 2010a). Im Zuge einer experimentellen Infektion (mit verschiedenen Isolaten; i. v. mit autologen infizierten Neutrophilen, nicht mit Zecken) wurden die Hunde ab zwei Tage p. i. PCR-positiv (Blut), eine Serokonversion trat ab zehn bis 14 Tage p. i. im IFAT ein, Morulae in Blutausstrichen waren zwischen Tag zehn und elf p. i. zu sehen (Scorpio et al. 2011). Dies macht deutlich, dass die Ergebnisse der diagnostischen Tests je nach Zeitpunkt p. i. variieren und daher ein gleichzeitiger Einsatz von Serologie und PCR die Wahrscheinlichkeit einer exakten Diagnose erhöht. Der quantitative ELISA als weiterführende Untersuchung im Labor erlaubt die Bestimmung der Antikörperkon-zentration im Blut und deren zeitlicher Fluktuation. Die Titer steigen innerhalb von zwei bis drei Wochen nach dem Nachweis im Blutausstrich an und können vier bis acht Monate nach dem ersten Bakteriennachweis im Ausstrich und unter Doxycyclintherapie abfallen (Egenvall et al. 1997). Ganzzell-basierte Tests (qELISA/IFAT) weisen Kreuzreaktion mit Antikörpern gegen Ehrlichia canis auf (Pantchev et al. 2015). Die Stärke der Kreuzreaktion solcher Sera verstärkt sich mit der Dauer der E. canis-Infektion und der Höhe des E.-canis-Titers (Harrus et al. 2012). Peptid-basierte serologische Tests wie der SNAP® 4Dx® Plus wiesen in epidemiologischen Studien keine Kreuzreaktionen zwischen den Gattungen Anaplasma und Ehrlichia auf (Pantchev et al. 2015). Die PCR für den direkten Erreger-DNA-Nachweis im Blut ist empfindlicher als der gefärbte Ausstrich. Experimentell infizierte Hunde werden dadurch sechs bis acht Tage früher -positiv getestet, als der Nachweis von Morulae im peripheren Blut gelingt (Scorpio et al. 2011). Die PCR erlaubt auch die Differenzierung von A. phagocytophilum und A. platys (Letztere ist wichtig bei Hunden mit Auslandsanamnese; Dyachenko et al. 2012), die wiederum serologisch miteinander kreuzreagieren (Gaunt et al. 2010).
Babesien
Die Diagnostik der caninen Babesiose schließt Auslandsanamnese inklusive Zeckenbefall, Bluttransfusion oder anderer Übertragungsmöglichkeiten (s. Teil 1), klinische Erscheinungen und Laborveränderungen, den direkten Erregernachweis im gefärbten Blutausstrich und/oder PCR sowie den indirekten Erregernachweis mittels Serologie (qELISA, IFAT) ein (Pantchev 2012a). Typische Laborbefunde sind eine hämolytische Anämie (zunächst aregenerativ, normozytär und normochrom; später regenerativ, makrozytär und hypochrom), eine sekundäre immunhämolytische Anämie mit positivem Coombs-Test, Sphärozyten sowie oftmals eine Leukozytose mit Linksverschiebung, Thrombozytopenie und Neutropenie. Weiterhin können eine Hämoglobinurie, Bilirubinurie, Bilirubinämie und Proteinurie (intravasale Hämolyse), ein Anstieg der Leber-enzyme (AST, ALT; Hepatopathie) und Azotämie sowie eine lang anhaltende Hypoalbuminämie (Hepato- und Glomerulopathie) beobachtet werden (Ayoob et al. 2010; Birkenheuer 2012). Je nach Babesien-Art existieren auch Unterschiede. So werden in Fällen von Theileria/Babesia annae (syn. Babesia microti-like, Babesia vulpes sp. nov.) bei Hunden in Nordwestspanien häufig auch Eosinopenie und Hyperglobulinämie festgestellt (Miro et al. 2015). Eine schlechte Prognose bei der akuten Babesiose durch B. canis war mit mäßiger Anämie, schwerer Thrombozytopenie, milder bis mäßiger Leukopenie, Hyperlaktatämie, mäßiger Hyperphosphatämie, Triglyceridämie und Hypoproteinämie assoziiert (Eichenberger et al. 2015).
Die Möglichkeiten spezifischer Diagnostik in der tierärztlichen Praxis während der akuten Phase sind beschränkt auf gefärbte Blutausstriche, die eine Unterscheidung -zwischen großen (Abb. 3) und kleinen Babesien ermöglichen. Kapilläres Blut oder eine Buffy-Coat-Präparation eignen sich oft besser, weil befallene Erythrozyten in Kapillaren sequestrieren bzw. Babesien eher Retikulozyten befallen als reife Erythrozyten (Irwin 2009; Ayoob et al. 2010; Ogo et al. 2011). Diese Unterscheidung gelingt gut bis auf seltene Fälle atypischer B.-canis-Stadien, die mit kleinen, abgerundeten Formen überraschen können. Kleine und große Babesien sollten diagnostisch klar -differenziert werden (z. B. mittels PCR, s. u.), denn die Therapie ist unterschiedlich. Weiterführende Untersuchungen in spezialisierten Laboren schließen die Serologie und PCR ein. Spezifische Antikörper konnten bei experimentell infizierten Hunden (mit D. reticulatus und B. canis) ab Tag 14 p. i. nachgewiesen werden (Jongejan et al. 2011). Nach einer experimentellen parenteralen Infektion mit B. vogeli bei Hunden wurden steigende Titer 14 bis 21 Tage p. i. und Höchsttiter (1:1.280 bis 1:5.120) 48 bis 55 Tage p. i. gesehen; sie fielen leicht ab bis Tag 160 (etwa um zwei Titer-Stufen) auf 1:640 bis 1:1.280 (Brandao et al. 2003). Die serologischen Ergebnisse der behandelten Gruppe (Imidocarb; sieben mg/kg; an den Tagen 15 und 27 p. i.) waren in dieser Studie signifikant unterschiedlich, in dem die Titer niedriger waren und schneller abfielen (ab dem Tag 34 p. i.). Eine (kapilläre) Parasitämie war bis 41 Tage p. i. (in dieser Phase intermittierend) zu beobachten (Brandao et al. 2003). Der Zeitpunkt des Verschwindens der Babesien aus dem Blut korrelierte in dieser Studie in etwa mit dem Erreichen der Höchsttiter. Die Limitierungen der Sero-logie liegen in Kreuzreaktionen (v. a. unter verschiedenen Babesien-Arten) und falsch-negativen Befunden bei jungen oder immun supprimierten Hunden oder früh in der Infektion, bevor eine Serokonversion eingetreten ist (Ayoob et al. 2010). Ein weiterer wichtiger Bestandteil der Babesien-Diagnostik beim Hund ist daher die PCR. Die einmalige mikroskopische Blutausstrich-Untersuchung hatte im Vergleich zur PCR als angesehenem „Goldstandard“ eine relative Sensitivität von nur 38 % und eine relative Spezifität von mehr als 99 % (Globokar Vrhovec 2013). Ein zusätzlicher Vorteil der PCR ist, dass im Anschluss an einen positiven Babesien-PCR-Befund eine Differenzierung der Babesien-Art etwa mittels artspezifischer Realtime-PCRs vorgenommen werden kann (Dyachenko et al. 2012), was bei der Auswahl des richtigen Wirkstoffs von entscheidender Bedeutung ist.


Literatur
Zitierungen in Klammern repräsentieren eine Auswahl; vollständige Literaturliste kann dem Originalartikel entnommen werden; folgende Artikel wurden ergänzt:
Eichenberger RM, Riond B, Willi B, Hofmann-Lehmann R, Deplazes P (2015): Prognostic Markers in Acute Babesia canis Infections. J Vet Intern Med. DOI: 10.1111/jvim.13822
Littman MP (2015). Emerging perspectives on hereditary glomerulopathies in canines. Advances in Genomics and Genetics 2015: 5 179–188
Miró G, Checa R, Paparini A, Ortega N, González-Fraga JL, Gofton A, Bartolomé A, Montoya A, Gálvez R, Mayo PP, Irwin P (2015): Theileria annae (syn. Babesia microti-like) infection in dogs in NW Spain detected using direct and indirect diagnostic techniques: clinical report of 75 cases. Parasit Vectors. 10;8: 217
Nather S, Globokar Vrhovec M, Frisch T, Huisinga E, Pantchev N (2016): Frühe Marker für Lyme-Nephritis beim Hund: Korreliert die quantitative Serologie mit SDMA? 24. Jahrestagung der FG Innere Medizin und klinische Labordiagnostik der DVG (InnLab) 29./30. Januar 2016 in Berlin. Abstrakt in der Tierärztl. Praxis Kleintiere 1/2016, 12–13 pp.
Pantchev N, Schnyder M, Vrhovec MG, Schaper R, Tsachev I (2015): Current Surveys of the Seroprevalence of Borrelia burgdorferi, Ehrlichia canis, Anaplasma phagocytophilum, Leishmania infantum, Babesia canis, Angiostrongylus vasorum and Dirofilaria immitis in Dogs in Bulgaria. Parasitol Res. 114 Suppl 1: S. 117–30
Philipp MT, Bowers LC, Fawcett PT, Jacobs MB, Liang FT, Marques AR, Mitchell PD, Purcell JE, Ratterree MS, Straubinger RK (2001): Antibody response to IR6, a conserved immunodominant region of the VlsE lipoprotein, wanes rapidly after antibiotic treatment of Borrelia burgdorferi infection in experimental animals and in humans. J Infect Dis. 184(7): 870-8.

Korrespondierender Autor:
Dr. med. vet. Nikola Pantchev, FTA für Parasitologie
nikola-pantchev@idexx.com
Abgekürzte Übersetzung der folgenden Originalarbeit: Pantchev N, Pluta S, Huisinga E, Nather S, Scheufelen M, Globokar Vrhovec M, Schweinitz A, Hampel H, Straubinger RK (2015): Tick-borne Diseases (Borreliosis, Anaplasmosis, Babesiosis) in German and Austrian Dogs: Status quo and Review of Distribution, Transmission, Clinical Findings, Diagnostics and Prophylaxis. Parasitol Res. 114 Suppl 1: S. 19–54
Der Originalartikel ist frei zugänglich unter dem Link:
link.springer.com/article/10.1007%2Fs00436-015-4513-0
