Antibiotikaresistenz-
Überwachung in Österreich<br>Symposium zum 9. Europäischen Antibiotikatag
Dr. med. vet. Peter Much und Bakk. rer. soc. oec. Hao Sun
AGES - Agentur für Gesundheit und Ernährungssicherheit GmbH
Ausgabe 01/2017

Der tierärztliche Einsatz von Antibiotika ist unweigerlich mit dem Risiko der Entstehung von Resistenzen bei bakteriellen Tierpathogenen, Zoonoseerregern und Kommensalen verbunden.
Info:
Das Symposium zum 9. European Antibiotic Awareness Day (EAAD) fand am 17. November 2016 im Festsaal des BMGF statt. Dort wurden nationale und internationale Beiträge zur Antibiotikaresistenz im Human- und Veterinärbereich sowie zum AURES-Bericht und multiresistenten Erregern vorgestellt. Die Vorträge finden Sie unter: www.ages.at/service/ages-akademie/programm-detail/kalender/detail/event/symposium_zum_9_antibiotikatag/
Seit dem Jahr 2004 werden in Österreich Antibiotikaresistenzen bei verschiedenen bakteriellen Isolaten von Nutztieren überwacht. Alle EU-Mitgliedstaaten sind dazu seit 2014 entsprechend dem Durchführungsbeschluss der Kommission 2013/652/EU verpflichtet. Die Umsetzung in Österreich erfolgt durch das Bundesministerium für Gesundheit und Frauen in Kooperation mit der AGES. An den Folgen von Infektionen mit resistenten Keimen sterben in der Europäischen Union (EU) pro Jahr etwa 25.000 Personen. Resistenzentwicklungen sind eine Folge des enormen Anpassungspotenzials von Mikroorganismen an sich ständig ändernde Umweltbedingungen. Resistenzentwicklung bedeutet, dass Keime, die ursprünglich durch eine bestimmte minimale Hemmstoffkonzentration (MHK) eines Antibiotikums im Wachstum gehemmt wurden, sich bei dieser Konzentration noch vermehren können. Der sogenannte epidemiologische Cut-off-Wert (ECOFF) unterteilt die Population einer Erregerspezies gegenüber einer antimikrobiellen Substanz in Wildtypen, die noch keine Resistenz zeigen, und Nicht-Wildtypen, die Resistenzen erworben haben. Mikrobielle Resistenz liegt vor, wenn die erforderliche MHK zur Wachstumshemmung oder Abtötung eines Erregers über der Konzentration für die Hemmung eines Wildtypen liegt. Somit können durch die Anwendung des ECOFFs bereits frühzeitig Verschiebungen von MHK-Werten innerhalb einer Bakterienpopulation erkannt und wichtige Hinweise auf eine mögliche beginnende Resistenzentwicklung gewonnen werden. Die ECOFFs erlauben jedoch keine Aussage zur klinischen Resistenz und damit über mögliche Behandlungserfolge bei Tier oder Mensch. So sind Mikroorganismen aus der Wildtyp-Population nicht automatisch mit einem bestimmten Wirkstoff mit guten Erfolgsaussichten behandelbar; andererseits sind Mikroorganismen aus der Nicht-Wildtyp-Population, die einen Resistenzmechanismus erworben haben, nicht automatisch klinisch resistent, z.B. wenn ein entsprechend höherer Wirkspiegel eines antimikrobiellen Stoffes im Zielgewebe erreicht werden kann.
Der Durchführungsbeschluss der Kommission 2013/652/EU schreibt genau vor, welche bakteriellen Erreger bei welchen Tierarten bzw. Lebensmitteln überwacht werden müssen, nach welchen Methoden untersucht werden muss etc. So sieht der Beschluss vor, dass in einem Jahr (2014, 2016, etc.) Geflügel und frisches Hühnerfleisch aus dem Einzelhandel, im folgenden Jahr jedoch Mastschweine und Rinder unter einem Jahr sowie Schweine- und Rindfleisch beprobt werden müssen; Tabelle 1 (S. 43) gibt die zu untersuchenden Erreger-Tierart-Kombinationen pro Jahr wieder. Der vorliegende Artikel beschreibt Ergebnisse des Überwachungsprogrammes aus den Jahren 2014 und 2015.
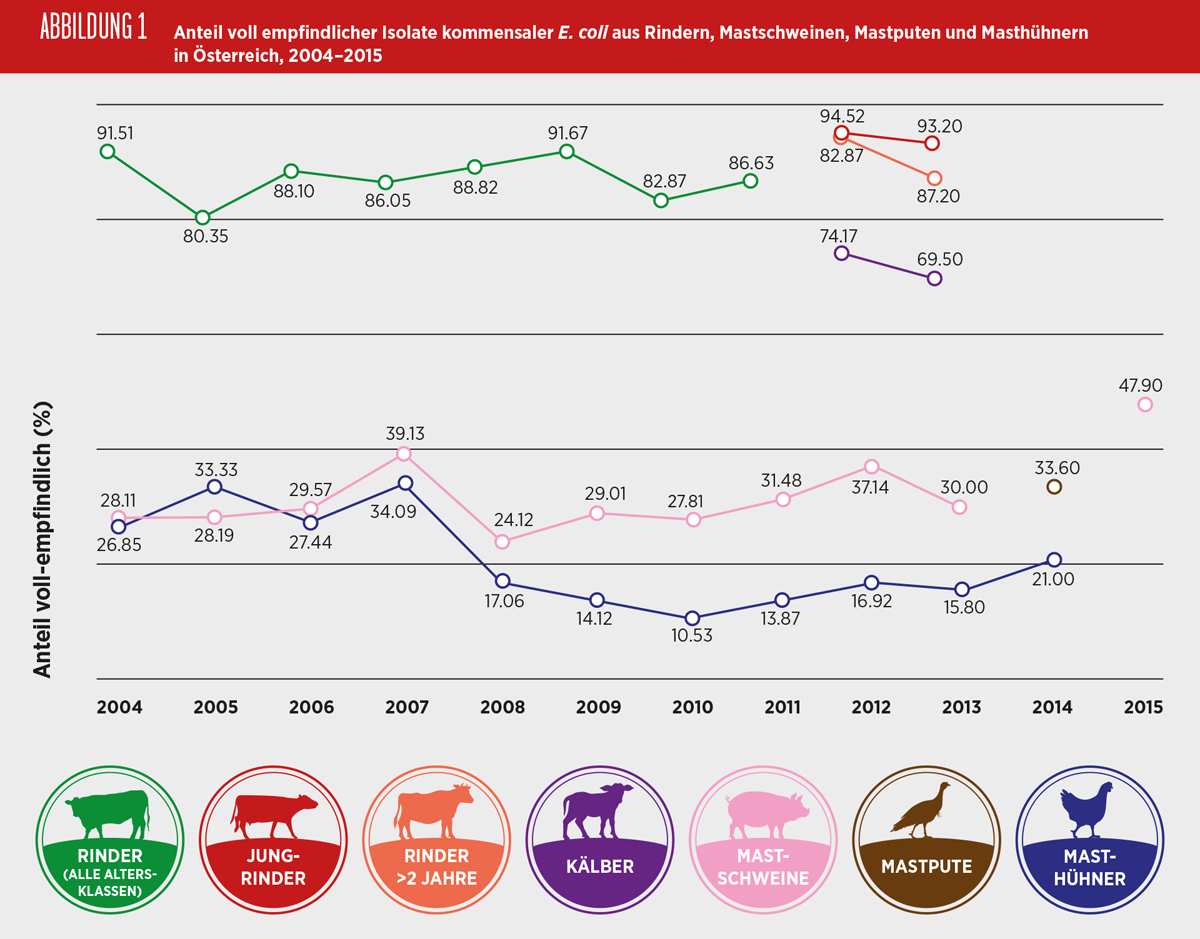
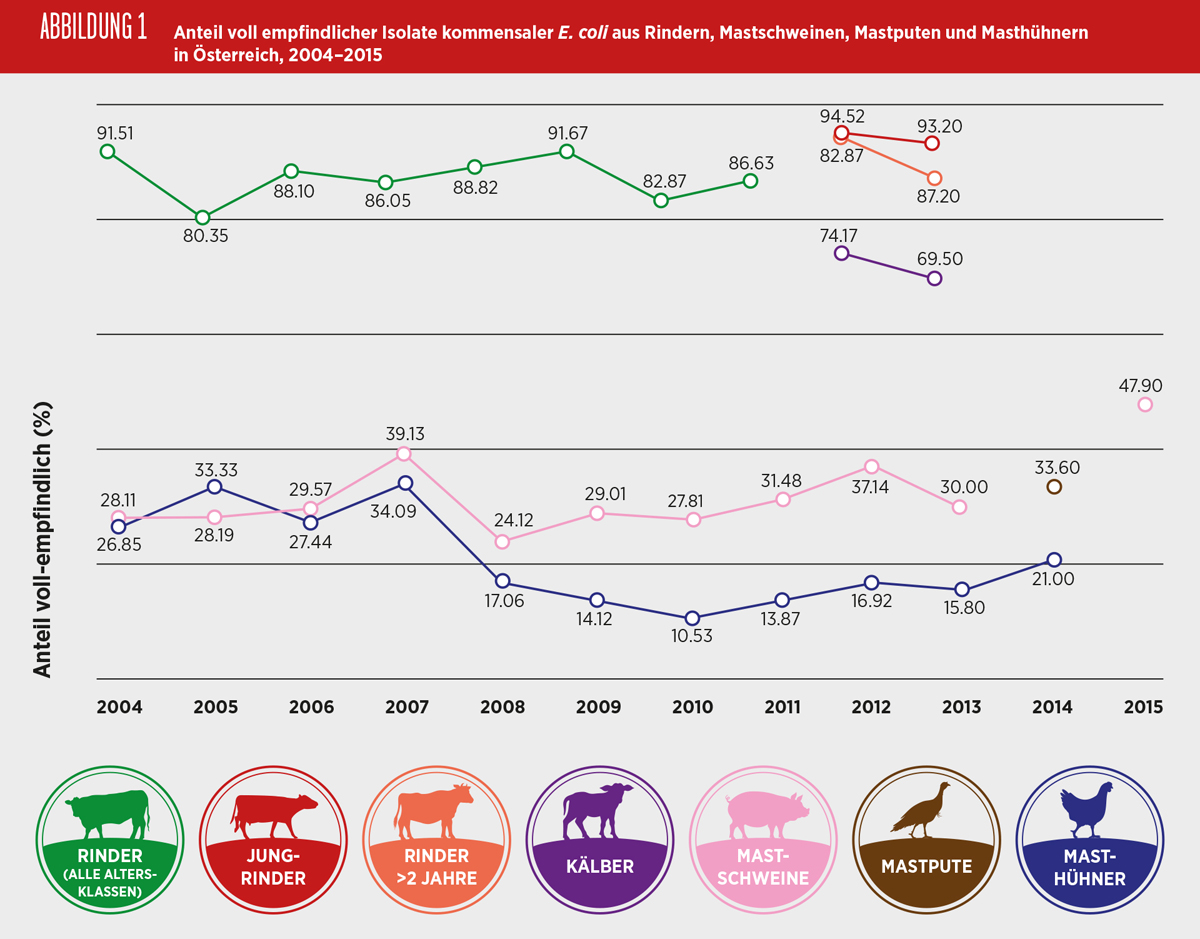
Indikator E. coli
E. coli kommen als Kommensale bei allen Nutztieren sowie beim Menschen im Darmtrakt vor. Die Verwendung von Antibiotika in der Nutztierhaltung kann die Selektion und Vermehrung von resistenten kommensalen Bakterien fördern, die dann direkt über die Nahrungskette – fäkale Kontamination, über den direkten Kontakt mit den Nutztieren oder indirekt über die Umwelt auf den Menschen übertragen werden können. Für die Humanmedizin besteht die Gefahr, dass resistente Bakterien ihre Resistenzgene durch horizontale Übertragung an die menschliche Kommensalflora sowie an für den Menschen pathogene Bakterien weitergeben. Daher soll die Antibiotikaresistenz bei kommensalen E. coli als Indikator bei Nutztieren überwacht werden, um einen möglichen Selektionsdruck zu erkennen, der auch auf andere Keime wie z.B. Zoonoseerreger einwirken könnte. Ebenso kann durch diese Überwachung das Resistenzverhalten von kommensalen Bakterien in verschiedenen Reservoirs (Schwein, Rind, Geflügel, Mensch) miteinander verglichen werden.
Der Anteil an E. coli, die gegenüber den 14 untersuchten antimikrobiellen Substanzen keine mikrobielle Resistenz aufwiesen, lag bei Isolaten gewonnen aus Caeca von Masthühnern bei 21%, von Puten bei 34% und bei Isolaten aus Caeca von Schweinen bei 48%. Bei Masthühnern und Schweinen wurde festgestellt, dass sich der Anteil an voll empfindlichen Isolaten bei beiden Tierarten verdoppelt hatte, von 10% seit 2010 bei den Isolaten von Masthühnern und von 24% seit 2008 bei Isolaten von Mastschweinen. Bei Puten wurde das Überwachungsprogramm erstmalig 2014 durchgeführt. Im Jahr 2013 wurden Isolate von Kälbern, Jungrindern und Rindern über zwei Jahre letztmalig untersucht, von denen jeweils 70%, 93% und 87% der Isolate vollständig empfindlich gegenüber den ausgetesteten Antibiotika waren.
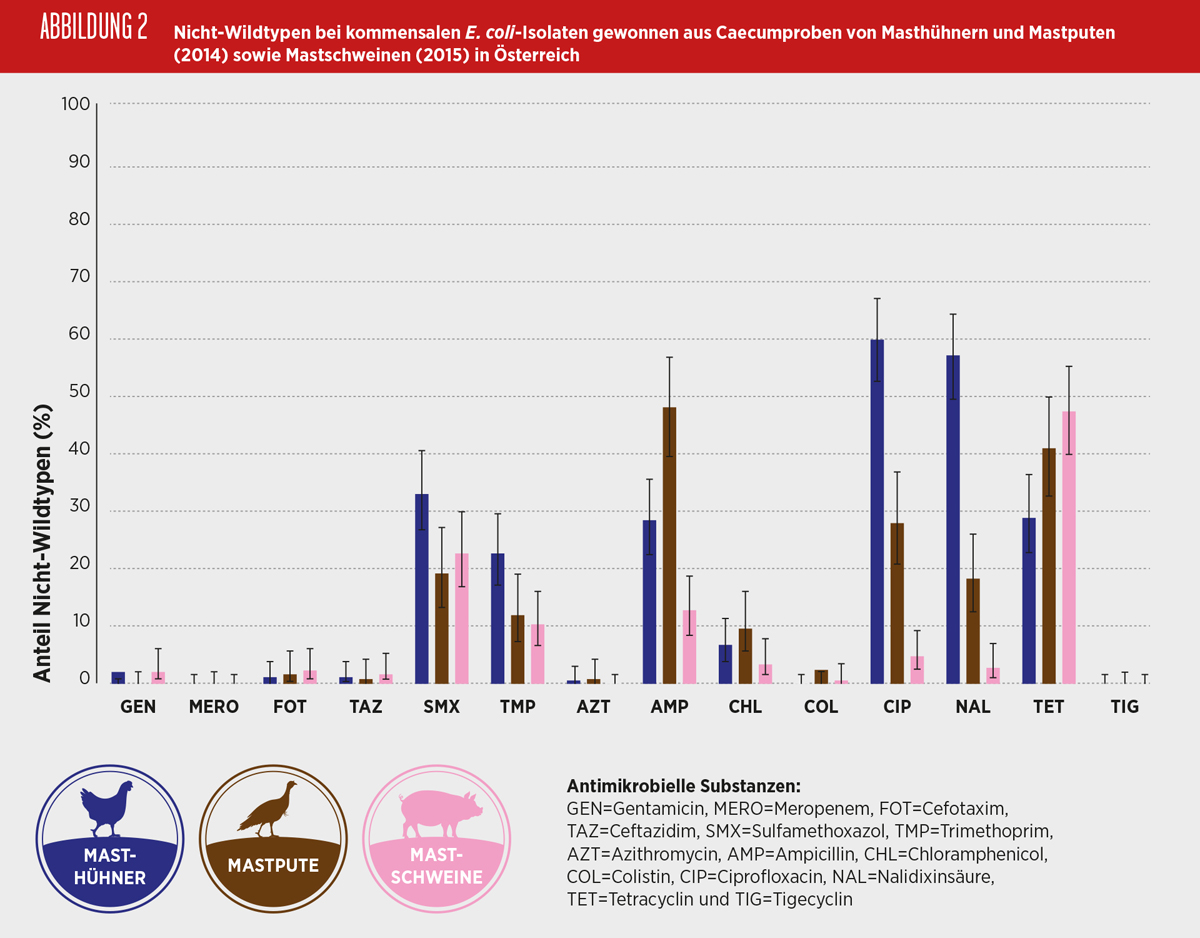
Der Anteil an Nicht-Wildtypen (bzw. mikrobiologisch resistenten Isolaten) war bei Isolaten von Masthühnern am höchsten gegenüber Fluorchinolonen (60%), bei Isolaten von Mastputen gegenüber Ampicillin (48%) und bei Isolaten von Mastschweinen gegenüber Tetracyclin (47%). Die Abbildung 2 stellt den Anteil an Nicht-Wildtypen bei kommensalen E. coli-Isolaten dar, gewonnen in Österreich aus Caecumproben von Masthühnern und Mastputen im Jahr 2014 und Mastschweinen im Jahr 2015.
ESBL-, AmpC- oder Carbapenemase-bildende E. coli
In den letzten Jahren sind weltweit vermehrt Breitspektrum β-Lactamase-produzierende Darmbakterien in Nutztieren nachgewiesen worden. Diese bilden β-Lactamasen mit erweitertem Spektrum (ESBL = Extended Spectrum β-Lactamase) oder besitzen plasmid-codierte AmpC Enzyme. β-Lactamasen sind Enzyme, die von den Bakterien gebildet werden, den β-Lactam-Ring aufspalten und die Antibiotika der Wirkstoffklasse der β-Lactame inaktivieren. ESBL-produzierende Darmbakterien sind resistent gegen die meisten β-Lactam-Antibiotika, insbesondere Aminopenicilline (z.B. Ampicillin), Cephalosporine (inklusive dritter und vierter Generation) und Monobactame. AmpC-β-Lactamasen vermitteln eine Resistenz gegen Penicilline, Cephalosporine der zweiten und dritten Generation (einschließlich der β-Laktam-Inhibitoren wie z.B. Clavulansäure) und Cephamycine, üblicherweise jedoch nicht gegen Cephalosporine der vierten Generation und Carbapeneme. Carbapenemase produzierende Enterobakterien sind nicht mehr voll empfindlich gegenüber Antibiotika aus der Klasse der Carbapeneme. Im Jahr 2015 wurden die Caecumproben von Mastschweinen sowie Frischfleischproben vom Schwein und Rind aus dem Einzelhandel mittels selektiver Nährmedien auf das Vorkommen dieser Enzyme-bildenden E. coli untersucht.
Aus 52% der untersuchten Caecum-Inhalte von Mast-schweinen konnten ESBL-/AmpC-bildende E. coli isoliert werden, ebenso aus 9% der untersuchten Schweinefleisch- und 3% der Rindfleischproben. Ein ESBL-bildender E. coli aus dem Caecum eines Schweines zeigte zusätzlich eine Resistenz gegenüber Colistin. Die Bedeutung von Colistin liegt in der Humanmedizin – trotz erheblicher Nebenwirkungen – darin, dass es sich um eine letzte verbliebene Therapieoption handelt, speziell bei Infektionen mit Carbapenem-resistenten Enterobakterien, wenn diese gegen andere, für den Menschen besser verträgliche Antibiotika unempfindlich sind. Die Überprüfung des Isolates ergab, dass diese Colistin-Resistenz durch das neu entdeckte mcr-1-Gen vermittelt wird, das auf einem Plasmid sitzt und daher leicht von einem Bakterium auf ein anderes übertragen werden kann und somit auch zwischen Tier und Mensch ausgetauscht werden könnte. Die molekularbiologische Typisierung der ESBL-/AmpC-bildenden Isolate wurde nicht durchgeführt. Carbapenemase-bildende E. coli konnten in keiner der untersuchten Proben gefunden werden.

Salmonella spp.
Die Betreiber von Schlachthöfen haben im Rahmen ihrer Eigenkontrollen dafür Sorge zu tragen, dass Schlachtkörper u. a. von Mastschweinen, Masthühnern und Mastputen am Schlachthof beprobt und auf Salmonellen untersucht werden. Die im Rahmen der Eigenkontrolle gewonnenen Isolate müssen an die nationale Referenzzentrale für Salmonellen (NRZ-S) zur Typisierung und Resistenztestung geschickt werden. Ebenso müssen alle Salmonella-Isolate, die im Zuge der Salmonellenbekämpfung aus Proben von Legehennen, Masthühnern und Puten kultiviert werden, in der NRZ-S typisiert und auf ihre Empfindlichkeit gegenüber antimikrobiellen Substanzen getestet werden.
Im Jahr 2015 wurden in keinem Schlachthof auf Schweine-karkassen Salmonellen gefunden. Im Jahr 2014 zeigten 56% der Salmonella-Isolate von Legehennen, 29% von Masthühnern und 7% der Isolate von Mastputen volle Empfindlichkeit gegenüber allen 14 ausgetesteten antimikrobiellen Substanzen. Die variierenden Anteile an voll empfindlichen Isolaten sind auf das unterschiedliche Spektrum an Salmonella-Serotypen bei den einzelnen Geflügelarten zurückzuführen, da die Resistenzprofile zwischen den Serotypen sehr unterschiedlich sind.
Campylobacter jejuni
Der Durchführungsbeschluss sieht vor, dass Campylobacter (C.) jejuni aus Caecum von geschlachtetem Geflügel, Masthuhn und Mastpute, gewonnen und auf ihre Empfindlichkeit gegenüber antimikrobiellen Substanzen getestet werden. 20% der untersuchten C. jejuni-Isolate aus Masthühnern und 21% aus Mastputen erwiesen sich als voll empfindlich gegenüber den neun ausgetesteten Substanzen. Seit 2004, dem Beginn des Resistenzmonitorings, wird eine Abnahme an voll empfindlichen C. jejuni-Isolaten beim Masthuhn beobachtet, ausgehend von 45% im Jahr 2004, die dem Wildtyp angehörten, mit den niedrigsten Anteilen in den Jahren 2007 (15%), 2012 (14%) und 2014 (29%). Die meisten Nicht-Wildtypen beim Masthuhn mit Anteilen von 75% und 68%, bei der Mastpute von 63% und 60% im Jahr 2014 zeigten sich gegenüber den Chinolonen, Ciprofloxacin und Nalidixinsäure resistent.
Zusammenfassung
Der Durchführungsbeschluss der Kommission 2013/652/EU gibt genau vor, welche Bakterien aus welchen Tierarten bzw. Nutzungsrichtungen gewonnen und auf ihre Empfindlichkeit gegenüber antimikrobiellen Substanzen getestet werden müssen. Die Anteile an voll empfindlichen Isolaten variierten bei den untersuchten Bakterien und Tierarten. Auch die Tendenzen im Hinblick auf Anstieg oder Verminderung von voll empfindlichen Bakterien in den letzten Jahren zeigen bei den getesteten Tierarten-Erreger-Kombinationen unterschiedliche Verläufe: Anstiege bei kommensalen E. coli jedoch Verminderungen bei Salmonellen und C. jejuni.
Ein Vergleich der hier vorgestellten Ergebnisse mit jenen aus der klinischen Humanmedizin ist nur einschränkt möglich, da in der Humanmedizin zur Bewertung der Empfindlichkeit der klinische Grenzwert herangezogen wird, der sich vom ECOFF bei manchen antimikrobiellen Stoffen unterscheidet, z.B. für E. coli gegenüber Cipro-floxacin liegt der klinische Grenzwert höher als der ECOFF (mikrobiologisch resistent > 0,06 mg/l, klinisch resistent > 1 mg/l). Auch werden in der klinischen Humanmedizin nur pathogene Keime, die von Patienten stammen, resistenzgetestet, wohingegen in der AMR-Überwachung Isolate von gesunden bzw. geschlachteten Tieren auf ihre Empfindlichkeit gegenüber antimikrobiellen Substanzen ausgetestet werden.
Die Details zu den einzelnen Ergebnissen und Trends können den Veterinärteilen des AURES 2014 und AURES 2015 entnommen werden.
Literatur (Auszug)
ECDC/EMEA JOINT TECHNICAL REPORT (2009) The bacterial challenge: time to react. A call to narrow the gap between multidrug-resistant bacteria in the EU and the development of new antibacterial agents. ecdc.europa.eu/en/publications/Publications/0909_TER_The_Bacterial_Challenge_Time_to_React.pdf (letzte Einsichtnahme 23.11.2016).
The European Committee on Antimicrobial Susceptibility Testing, EUCAST (2013) EUCAST definitions of clinical breakpoints and epidemiological cut-off values www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/EUCAST_SOPs/EUCAST_definitions_of_clinical_breakpoints_and_ECOFFs.pdf (letzte Einsichtnahme 2.05.2016).
Schwarz S, Feßler AT, Kaspar H, Werckenthin C, Wallmann J (2014) Empfindlichkeitsprüfung von Bakterien im diagnostischen Labor. Der praktische Tierarzt 95 (Suppl. 5); S. 18–22.
32013D0652: 2013/652/EU: Durchführungsbeschluss der Kommission vom 12. November 2013 zur Überwachung und Meldung von Antibiotikaresistenzen bei zoonotischen und kommensalen Bakterien (Bekanntgegeben unter Aktenzeichen C(2013) 7145).
Bush K and Jacoby GA (2010) Updated Functional Classification of β-Lactamases. Antimicrobial Agents and Chemotherapy 2010; 54(3); pp. 969–76.
Much P, Sun H (2015) Antibiotikaresistenz bei ausgewählten Zoonoseerregern und Indikatorbakterien. Daten aus dem Veterinärbereich, 2014. In: Resistenzbericht Österreich AURES 2014, Herausgeber: Bundesministerium für Gesundheit (BMG), ISBN Nr. 978-3-902611-89-7, Auflage: November 2015; pp. 232–325.
Much P, Sun H (2016) Bericht über das Antibiotikaresistenz-Monitoring gemäß Durchführungsbeschluss der Kommission 2013/652/EU in Österreich, 2015. In: Resistenzbericht Österreich AURES 2015, Herausgeber: Bundesministerium für Gesundheit und Frauen (BMGF), ISBN Nr. ISBN Nr. 978-3-903099-11-1, Auflage: November 2016; pp. 239–284.
